Vàng(III) chloride
| Vàng(III) chloride | |
|---|---|
 | |
 | |
 | |
| Danh pháp IUPAC | Gold(III) trichloride |
| Tên khác | Auric chloride Vàng trichloride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| ChEBI | |
| Số RTECS | MD5420000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Công thức phân tử | AuCl 3 (tồn tại dưới dạng Au 2Cl 6) |
| Khối lượng mol | 606,6511 g/mol |
| Bề ngoài | Tinh thể màu đỏ (dạng khan) Tinh thể màu vàng (dạng monohydrat)[1] |
| Khối lượng riêng | 4,7 g/cm3 |
| Điểm nóng chảy | 160 °C (433 K; 320 °F) (phân hủy) |
| Điểm sôi | |
| Độ hòa tan trong nước | 68 g/100 ml (20 °C) |
| Độ hòa tan | tan trong ether và ethanol, tan ít trong amonia lỏng, không tan trong benzen |
| MagSus | −112·10−6 cm3/mol |
| Cấu trúc | |
| Cấu trúc tinh thể | Đơn nghiêng |
| Nhóm không gian | P21/C |
| Hằng số mạng | a = 6,57 Å, b = 11,04 Å, c = 6,44 Å |
| Tọa độ | Vuông phẳng |
| Nhiệt hóa học | |
| Các nguy hiểm | |
| Nguy hiểm chính | Chất kích ứng |
| Ký hiệu GHS |  |
| Báo hiệu GHS | Cảnh báo |
| Chỉ dẫn nguy hiểm GHS | H315, H319, H335 |
| Chỉ dẫn phòng ngừa GHS | P261, P264, P271, P280, P302+P352, P305+P351+P338 |
| Các hợp chất liên quan | |
| Anion khác | Vàng(III) fluoride Vàng(III) bromide Vàng(III) iodide |
| Cation khác | Vàng(I) chloride Bạc(I) chloride Platin(II) chloride Thủy ngân(II) chloride |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Vàng(III) chloride là một hợp chất vô cơ của vàng và chlor, công thức phân tử là Au
2Cl
6. Số La Mã "III" trong danh pháp xuất phát từ trạng thái oxy hóa +3 của vàng. Đây là trạng thái điển hình cho nhiều hợp chất của vàng. Vàng(III) chloride có hai dạng, dạng monohydrat (AuCl
3·H
2O) và dạng khan, cả hai đều là chất rắn có khả năng hút ẩm và nhạy cảm với ánh sáng. Au
2Cl
6 là dạng dimer của AuCl
3. Hợp chất này có một số công dụng như là tác nhân oxy hóa và xúc tác cho các phản ứng hữu cơ khác nhau.
Cấu trúc phân tử
[sửa | sửa mã nguồn]AuCl
3 tồn tại dưới dạng dimer là Au
2Cl
6 ở dạng rắn và hơi, phân tử có phối tử chloride làm cầu nối.[2] Vàng(III) bromide cũng có tính chất tương tự, phân tử tồn tại dưới dạng dimer Au
2Br
6.[1]
Mỗi trung tâm nguyên tử vàng tạo với 4 nguyên tử chlor theo hình vuông phẳng, điển hình cho phức kim loại có số electron phân lớp d là 8 (d8). Liên kết trong AuCl
3 được coi là liên kết cộng hóa trị.[1]
Tính chất
[sửa | sửa mã nguồn]Vàng(III) chloride là chất rắn kết tinh màu đỏ, nhạy cảm với ánh sáng, tạo thành monohydrat AuCl
3·H
2O màu da cam. Vàng(III) chloride dạng khan và vàng(III) chloride dạng monohydrat đều có tính chất hút ẩm. Dạng khan hút ẩm từ không khí để tạo thành monohydrat, từ dạng monohydrat có thể quay trở về dạng khan bằng cách sử dụng thionyl chloride.[3]
Điều chế
[sửa | sửa mã nguồn]Năm 1951, vàng(III) chloride được điều chế bằng phản ứng của bột kim loại vàng với iod monochloride:[3]
- 2 Au + 6 ICl → 2 AuCl
3 + 3 I
2
Tuy nhiên, hợp chất này thường được điều chế bằng cách cho khí chlor đi qua bột vàng ở 180 °C (356 °F):[1]
- 2 Au + 3 Cl
2 → Au
2Cl
6
Phản ứng chlor hóa có thể thực hiện với tetrabutylammonium chloride, sản phẩm là muối ưa lipid tetrabutylammonium tetrachloraurat.[4]
Một phương pháp điều chế khác là dùng acid chloroauric, điều chế chất này bằng cách hòa tan bột vàng trong nước cường toan để tạo ra acid chloroauric:[5]
- Au + HNO
3 + 4 HCl → H[AuCl
4] + 2 H
2O + NO
Nung acid chloroauric trong khí trơ ở nhiệt độ khoảng 100 °C thu được Au
2Cl
6:[6][7]
- 2 H[AuCl
4] → Au
2Cl
6 + 2 HCl
Phản ứng hóa học
[sửa | sửa mã nguồn]
Phản ứng phân hủy
[sửa | sửa mã nguồn]AuCl
3 dạng khan bắt đầu phân hủy thành AuCl (vàng(I) chloride) tại nhiệt độ khoảng 160 °C (320 °F). Tuy nhiên, ở nhiệt độ cao hơn, phản ứng tự oxy hóa khử xảy ra, sản phẩm thu được gồm kim loại vàng và AuCl
3:[3][6]
- AuCl
3 → AuCl + Cl
2 (160 °C) - 3 AuCl → AuCl
3 + 2 Au (> 210 °C)
Do AuCl xảy ra phản ứng tự oxy hóa khử, trên 210 °C, hầu hết sản phẩm chứa vàng đều ở dạng vàng nguyên tố.[7][8]
Vàng(III) chloride ổn định hơn trong khí quyển chlor và có thể thăng hoa ở nhiệt độ khoảng 200 °C mà không xảy ra phản ứng phân hủy. Trong môi trường chlor, AuCl
3 bị phân hủy ở 254 °C thu được AuCl, và AuCl bị phân hủy ở 282 °C thành vàng nguyên tố.[2][9]
Các phản ứng khác
[sửa | sửa mã nguồn]AuCl
3 là acid Lewis và dễ dàng tạo phức. Ví dụ, AuCl
3 phản ứng với acid hydrochloric để tạo thành acid chloroauric (H[AuCl
4]):[10]
- HCl + AuCl
3 → H+
+ [AuCl
4]−
Acid chloroauric là sản phẩm được hình thành khi hòa tan vàng trong nước cường toan.[10]
Khi hòa tan vào nước, AuCl
3 tạo thành hydrat acid và base liên hợp [AuCl
3(OH)]−
. Ion Fe2+ khử AuCl
3, kết tủa vàng kim loại tạo thành.[1]
Các hợp chất chloride khác, chẳng hạn như KCl, chuyển AuCl
3 thành [AuCl
4]−
. Dung dịch nước của AuCl
3 phản ứng với một base tan trong nước như natri hydroxide, tạo thành kết tủa Au(OH)
3. Kết tủa này hòa tan trong NaOH dư để tạo thành natri aurat (NaAuO
2). Nếu đun nóng nhẹ, Au(OH)
3 phân hủy thành vàng(III) oxide (Au
2O
3), tiếp tục đun nóng sẽ tạo tủa kim loại vàng.[10][11][12][13]
Vàng(III) chloride được coi là "điểm khởi đầu" để tổng hợp của nhiều hợp chất vàng khác. Ví dụ, phản ứng với kali cyanide tạo ra phức chất tan trong nước, K[Au(CN)
4]:[14]
- AuCl
3 + 4 KCN → K[Au(CN)
4] + 3 KCl
Tổng hợp vàng(III) fluoride từ AuCl
3 bằng cách cho AuCl
3 phản ứng với brom trifluoride (BrF
3).[10]
Vàng(III) chloride phản ứng với benzen trong điều kiện thường (thời gian phản ứng kéo dài vài phút ở nhiệt độ phòng) để tạo ra dimer phenylvàng(III) dichloride. Nhiều loại aren khác cũng có phản ứng tương tự:[15]
- 2 PhH + Au
2Cl
6 → [PhAuCl
2]
2 + 2 HCl
Vàng(III) chloride phản ứng với carbon monoxide theo nhiều cách khác nhau. Ví dụ, phản ứng của AuCl
3 khan và carbon monoxide trong SOCl
2 tạo ra vàng(I,III) chloride. Au(CO)Cl là chất trung gian:[16][17]
- 2 AuCl
3 + 2 CO → Au
4Cl
8 + 2 COCl
2
Nếu carbon monoxide dư thừa, sản phẩm phản ứng sẽ là Au(CO)Cl.[18][19]
Tuy nhiên, trong môi trường tetrachloroethylen, ở 120 °C, vàng(III) chloride đầu tiên bị khử thành vàng(I) chloride, chất này tiếp tục phản ứng để tạo thành Au(CO)Cl. AuCl
3 là chất xúc tác cho quá trình sản xuất phosgene.[19][20]
Vàng(III) chloride tạo một số hợp chất với amonia, như AuCl
3[NH
3] là chất rắn màu vàng, D = 3,97 g/cm³,[21] hay AuCl
3[NH
3]
4 là chất rắn không màu.[22]
Ứng dụng
[sửa | sửa mã nguồn]Mặc dù vàng(III) chloride không có công dụng thương mại nhưng chất này có nhiều công dụng trong phòng thí nghiệm.[3]
Tổng hợp hữu cơ
[sửa | sửa mã nguồn]Năm 2003, nhà hóa học hữu cơ nghiên cứu AuCl
3 với vai trò là chất xúc tác acid nhẹ cho các phản ứng khác nhau,[23] mặc dù không có biến đổi hóa học của hợp chất này được thương mại hóa. Muối vàng(III), đặc biệt là Na[AuCl
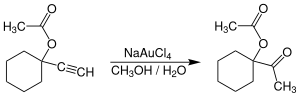
4], là chất xúc tác thay thế cho muối thủy ngân(II) cho các phản ứng liên quan đến alkyn. Ví dụ dưới dây là phản ứng hydrat hóa của các alkyn có liên kết ba ở vị trí đầu mạch, tạo ra các hợp chất acetyl.[24]
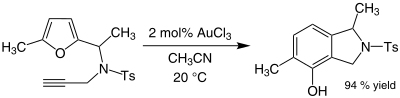
Vàng xúc tác quá trình alkyl hóa một số vòng thơm và biến đổi furan thành phenol. Một số alkyn tham gia phản ứng amin hóa dưới xúc tác vàng(III). Ví dụ, hỗn hợp acetonitrile và vàng(III) chloride xúc tác quá trình alkyl hóa 2-methylfuran bằng methyl vinyl ketone ở vị trí C5:[25]
Hiệu quả phản ứng của hợp chất cơ-vàng (một loại hợp chất cơ kim) rất đáng chú ý vì cả furan và ketone đều nhạy cảm với các phản ứng phụ như phản ứng trùng hợp trong điều kiện acid. Trong một số trường hợp alkyn có thể tạo sản phẩm phụ là phenol (Ts là chữ viết tắt của tosyl):[25]
Phản ứng này có sự chuyển vị, tạo ra một vòng thơm mới.[26]
Một ví dụ khác về phản ứng xúc tác AuCl
3 là phản ứng hydroaryl hóa, về cơ bản là phản ứng Friedel-Crafts sử dụng phức kim loại-alkyn. Ví dụ, phản ứng của mesitylen với phenylacetylen:[27]
Vàng(III) chloride được sử dụng để oxy hóa trực tiếp các amin bậc một thành ketone, chẳng hạn như oxy hóa cyclohexylamin thành cyclohexanon:[3]
Phản ứng này nhạy cảm với pH, đòi hỏi phải tiến hành trong môi trường có độ pH acid nhẹ. Tuy nhiên, phản ứng không yêu cầu bổ sung thêm bất kỳ bước tổng hợp nào.[3]
Trong quá trình điều chế các hợp chất cơ-vàng(III), AuCl
3 được sử dụng làm nguồn cung cấp nguyên tố vàng. Ví dụ, phức hợp monoarylvàng(III) được điều chế bằng cách cho phản ứng giữa các aren với vàng(III) chloride.[28]
Hạt nano vàng
[sửa | sửa mã nguồn]Vàng(III) chloride được sử dụng trong quá trình tổng hợp các hạt nano vàng (colloidal gold), được nghiên cứu rộng rãi về các đặc tính và ứng dụng phụ thuộc vào kích thước độc đáo của chúng trong các lĩnh vực như điện tử, quang học và y sinh. Điều chế hạt nano vàng bằng cách khử vàng(III) chloride bằng chất khử như natri tetrafluoroborat, sau đó là ổn định bằng chất phủ.[29]
Nhiếp ảnh
[sửa | sửa mã nguồn]Vàng(III) chloride từng được sử dụng trong ngành công nghiệp nhiếp ảnh như một chất cảm xạ (sensitizer) trong sản xuất phim ảnh. Tuy nhiên, công dụng của hợp chất trong lĩnh vực này đã bị hạn chế dần khi nhiếp ảnh kỹ thuật số xuất hiện.[30]
Tồn tại trong tự nhiên
[sửa | sửa mã nguồn]Hợp chất này không tồn tại trong môi trường tự nhiên, tuy nhiên, một hợp chất tương tự có công thức AuO(HCl)·nH
2O được biết đến như một sản phẩm của quá trình oxy hóa vàng tự nhiên.[31]
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c d e Egon Wiberg; Nils Wiberg; A. F. Holleman (2001). Inorganic Chemistry (ấn bản 101). Academic Press. tr. 1286–1287. ISBN 978-0-12-352651-9.
- ^ a b E. S. Clark; D. H. Templeton; C. H. MacGillavry (1958). “The crystal structure of gold(III) chloride”. Acta Crystallogr. 11 (4): 284–288. doi:10.1107/S0365110X58000694. Truy cập ngày 21 tháng 5 năm 2023.
- ^ a b c d e f Michael J. Coghlan; Rene-Viet Nguyen; Chao-Jun Li; Daniel Pflästerer; A. Stephen K. Hashmi (2015). “Gold(III) Chloride”. Encyclopedia of Reagents for Organic Synthesis: 1–24. doi:10.1002/047084289X.rn00325.pub3. ISBN 9780470842898.
- ^ Buckley, Robbie W.; Healy, Peter C.; Loughlin, Wendy A. (1997). “Reduction of [NBu4][AuCl4] to [NBu4][AuCl2] with Sodium Acetylacetonate”. Australian Journal of Chemistry. 50 (7): 775. doi:10.1071/C97029.
- ^ Block, B. P. (1953). “Gold Powder and Potassium Tetrabromoaurate(III)”. Inorganic Syntheses. 4: 14–17. doi:10.1002/9780470132357.ch4. ISBN 9780470132357.
- ^ a b Ya-jie Zheng; Wei Guo; Meng Bai; Xing-wen Yang (2006). “Preparation of chloroauric acid and its thermal decomposition”. The Chinese Journal of Nonferrous Metals (bằng tiếng chinese). 16 (11): 1976–1982.Quản lý CS1: ngôn ngữ không rõ (liên kết)
- ^ a b Robert G. Palgrave; Ivan P. Parkin (2007). “Aerosol Assisted Chemical Vapor Deposition of Gold and Nanocomposite Thin Films from Hydrogen Tetrachloroaurate(III)”. Chemistry of Materials (bằng tiếng Anh). ACS Publications. 19 (19): 4639–4647. doi:10.1021/cm0629006.
- ^ Yiqin Chen; Xuezeng Tian; Wei Zeng; Xupeng Zhu; Hailong Hu; Huigao Duan (2015). “Vapor-phase preparation of gold nanocrystals by chloroauric acid pyrolysis”. Journal of Colloid and Interface Science (bằng tiếng Anh). Elsevier. 439: 21–27. Bibcode:2015JCIS..439...21C. doi:10.1016/j.jcis.2014.10.017. PMID 25463171.
- ^ E.M.W. Janssen; J.C.W. Folmer; G.A. Wiegers (1974). “The preparation and crystal structure of gold monochloride, AuCl”. Journal of the Less Common Metals (bằng tiếng Anh). 38 (1): 71–76. doi:10.1016/0022-5088(74)90204-5.
- ^ a b c d N. N. Greenwood; A. Earnshaw (1997). Chemistry of the Elements (bằng tiếng Anh) (ấn bản 2). Oxford, UK: Butterworth-Heinemann. tr. 1184–1185. ISBN 9780750633659.
- ^ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Ed., 2006, p. 780, ISBN 978-0-911910-00-1.
- ^ H. Nechamkin, The Chemistry of the Elements, McGraw-Hill, New York, 1968, p. 222
- ^ A. F. Wells, Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984, p. 909
- ^ Henry K. Lutz (1961). “Synthesis and Analyses of KAu(CN)4”. Honors Theses. (bằng tiếng Anh). Union Digital Works.
- ^ Li, Zigang; Brouwer, Chad; He, Chuan (ngày 1 tháng 8 năm 2008). “Gold-Catalyzed Organic Transformations”. Chemical Reviews. 108 (8): 3239–3265. doi:10.1021/cr068434l. ISSN 0009-2665. PMID 18613729.
- ^ Daniela Belli Dell'Amico; Fausto Calderazzo; Fabio Marchetti; Stefano Merlino; Giovanni Perego (1977). “X-Ray crystal and molecular structure of Au4Cl8, the product of the reduction of Au2Cl6 by Au(CO)Cl”. Journal of the Chemical Society, Chemical Communications (bằng tiếng Anh): 31–32. doi:10.1039/C39770000031.
- ^ Daniela Belli Dell'Amico; Fausto Calderazzo; Fabio Marchetti; Stefano Merlino (1982). “Synthesis and molecular structure of [Au4Cl8], and the isolation of [Pt(CO)Cl5]– in thionyl chloride”. Journal of the Chemical Society, Dalton Transactions (bằng tiếng Anh) (11): 2257–2260. doi:10.1039/DT9820002257.
- ^ Dell'Amico, D. Belli; Calderazzo, F.; Murray, H. H.; Fackler, J. P. (1986). “Carbonylchlorogold(I)”. Inorganic Syntheses. Inorganic Syntheses. 24. tr. 236–238. doi:10.1002/9780470132555.ch66. ISBN 9780470132555.
- ^ a b T.A. Ryan; E.A. Seddon; K.R. Seddon; C. Ryan (1996). Phosgene And Related Carbonyl Halides (bằng tiếng Anh). Elsevier Science. tr. 242–243. ISBN 9780080538808.
- ^ M. S. Kharasch; H. S. Isbell (1930). “The Chemistry of Organic Gold Compounds. I. Aurous Chloride Carbonyl and a Method of Linking Carbon to Carbon”. Journal of the American Chemical Society (bằng tiếng Anh). 52 (7): 2919–2927. doi:10.1021/ja01370a052.
- ^ Villars, Pierre; Cenzual, Karin; Gladyshevskii, Roman (ngày 24 tháng 7 năm 2017). Handbook (bằng tiếng Anh). Walter de Gruyter GmbH & Co KG. ISBN 978-3-11-043655-6.
- ^ Durrant, Philip John; Durrant, Beryl (1962). Introduction to Advanced Inorganic Chemistry (bằng tiếng Anh). Longmans. tr. 1074.
- ^ G. Dyker, An Eldorado for Homogeneous Catalysis?, in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.), pp 48–55, Wiley-VCH, Weinheim, 2003
- ^ Y. Fukuda; K. Utimoto (1991). “Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst”. J. Org. Chem. 56 (11): 3729. doi:10.1021/jo00011a058.
- ^ a b A. S. K. Hashmi; T. M. Frost; J. W. Bats (2000). “Highly Selective Gold-Catalyzed Arene Synthesis”. J. Am. Chem. Soc. 122 (46): 11553. doi:10.1021/ja005570d.
- ^ A. Stephen; K. Hashmi; M. Rudolph; J. P. Weyrauch; M. Wölfle; W. Frey; J. W. Bats (2005). “Gold Catalysis: Proof of Arene Oxides as Intermediates in the Phenol Synthesis”. Angewandte Chemie International Edition. 44 (18): 2798–801. doi:10.1002/anie.200462672. PMID 15806608.
- ^ Reetz, M. T.; Sommer, K. (2003). “Gold-Catalyzed Hydroarylation of Alkynes”. European Journal of Organic Chemistry. 2003 (18): 3485–3496. doi:10.1002/ejoc.200300260.
- ^ Kharasch, M. S.; Isbell, Horace S. (ngày 1 tháng 8 năm 1931). “The Chemistry of Organic Gold Compounds. III. Direct Introduction of Gold into the Aromatic Nucleus (Preliminary Communication)”. Journal of the American Chemical Society. 53 (8): 3053–3059. doi:10.1021/ja01359a030. ISSN 0002-7863.
- ^ M. Lin; C. M. Sorensen; K. J. Klabunde (1999). “Ligand-Induced Gold Nanocrystal Superlattice Formation in Colloidal Solution”. Chemistry of Materials (bằng tiếng Anh). 11 (2): 198–202. doi:10.1021/cm980665o.
- ^ Philip Ellis (1975). “Gold in photography”. Gold Bulletin (bằng tiếng Anh). 8: 7–12. doi:10.1007/BF03215055.
- ^ “UM1995-16-O:AuClH”. mindat.org. Truy cập ngày 21 tháng 5 năm 2023.
Liên kết ngoài
[sửa | sửa mã nguồn] Tư liệu liên quan tới Gold trichloride tại Wikimedia Commons
Tư liệu liên quan tới Gold trichloride tại Wikimedia Commons