Đồng(I) chloride
| Đồng(I) chloride | |
|---|---|
 Một mẫu đồng(I) chloride | |
 Đơn vị cơ sở của quặng nantokite | |
| Danh pháp IUPAC | Copper(I) chloride |
| Tên khác | Cuprous chloride
Đồng monochloride Cuprum(I) chloride Cuprum monochloride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| DrugBank | DB15535 |
| ChEBI | |
| Số RTECS | GL6990000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Tham chiếu Beilstein | 8127933 |
| Tham chiếu Gmelin | 13676 |
| UNII | |
| Thuộc tính | |
| Công thức phân tử | CuCl |
| Khối lượng mol | 98.999 g/mol[1] |
| Bề ngoài | bột màu trắng, hơi xanh do tạp chất oxy hóa |
| Khối lượng riêng | 4.14 g/cm3[1] |
| Điểm nóng chảy | 423 °C (696 K; 793 °F)[1] |
| Điểm sôi | 1.490 °C (1.760 K; 2.710 °F) (phân hủy)[1] |
| Độ hòa tan trong nước | 0.047 g/L (20 °C)[1] |
| Tích số tan, Ksp | 1.72×10−7 |
| Độ hòa tan | không tan trong ethanol, acetone;[1] tan trong dung dịch HCl đặc và NH4OH |
| BandGap | 3.25 eV (300 K, trực tiếp)[2] |
| MagSus | -40.0·10−6 cm3/mol[3] |
| Chiết suất (nD) | 1.930[4] |
| Cấu trúc | |
| Cấu trúc tinh thể | Zincblende, cF20 |
| Nhóm không gian | F43m, No. 216[5] |
| Hằng số mạng | a = 0.54202 nm |
| Các nguy hiểm | |
| NFPA 704 |
|
| Điểm bắt lửa | Không cháy |
| PEL | TWA 1 mg/m3 (theo Cu)[6] |
| LD50 | 140 mg/kg |
| REL | TWA 1 mg/m3 (theo Cu)[6] |
| IDLH | TWA 100 mg/m3 (theo Cu)[6] |
| Ký hiệu GHS |   |
| Báo hiệu GHS | Cảnh báo |
| Chỉ dẫn nguy hiểm GHS | H302, H410 |
| Chỉ dẫn phòng ngừa GHS | P264, P270, P273, P301+P312, P330, P391, P501 |
| Các hợp chất liên quan | |
| Anion khác | Đồng(I) fluoride Đồng(I) bromide Đồng(I) iodide |
| Cation khác | Bạc(I) chloride Vàng(I) chloride |
| Hợp chất liên quan | Đồng(II) chloride |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |

Đồng(I) chloride là hợp chất chloride của đồng hóa trị một, công thức hóa học là CuCl. Hợp chất này tồn tại dưới dạng một chất rắn màu trắng rất ít tan trong nước, nhưng tan nhiều trong dung dịch acid hydrochloric đặc. Các mẫu hợp chất này không tinh khiết, thường có màu xanh lá cây do tạp chất đồng(II) chloride (CuCl
2).
Lịch sử[sửa | sửa mã nguồn]
Giữa thế kỷ 17, Robert Boyle là người đầu tiên điều chế đồng(I) chloride thủy ngân(II) chloride và kim loại đồng:[7]
- HgCl
2 + 2 Cu → 2 CuCl + Hg
Năm 1799, JL Proust mô tả hai loại chloride đồng khác nhau. Ông điều chế CuCl bằng cách nung nóng CuCl
2 trong điều kiện không có không khí, làm mất đi nửa lượng chlor trong mẫu, sau đó lọc bỏ CuCl
2 dư bằng cách rửa mẫu sau khi nung bằng nước.[8]
Dung dịch có tính acid của CuCl trước đây được sử dụng để phân tích hàm lượng carbon monoxide trong chất khí, ví dụ như trong thiết bị phân tích khí của Hempel, sử dụng CuCl để hấp thụ carbon monoxide.[9] Ứng dụng này rất có ý nghĩa trong thế kỷ 19 và đầu thế kỷ 20 khi khí than được sử dụng rộng rãi để sưởi ấm và chiếu sáng.[10]
Điều chế[sửa | sửa mã nguồn]
Đồng(I) chloride được sản xuất công nghiệp bằng cách cho km loại đồng phản ứng trực tiếp với chlor ở nhiệt độ 450–900 °C:[11][12]
- 2 CuCl
2 + SO
2 + 2 H
2O → 2 CuCl + H
2SO
4 + 2 HCl - 2 CuCl
2 + C
6H
8O
6 → 2CuCl + 2HCl + C
6H
6O
6
Đồng(I) chloride cũng có thể được điều chế bằng cách khử đồng(II) chloride bằng sulfur dioxide, hoặc bằng acid ascorbic (vitamin C) có tính chất như một đường khử:[13][14]
- 2 Cu + Cl
2 → 2 CuCl
Có thể sử dụng nhiều chất khử khác.[12]
-
Tinh thể đồng(I) chloride màu trắng trên dây đồng
-
Đồng(I) chloride bị oxy hóa một phần trong không khí
Tính chất[sửa | sửa mã nguồn]
Đồng(I) chloride có cấu trúc tinh thể lập phương ở điều kiện thường. Khi nung nóng đến 408 °C, cấu trúc tinh thể thay đổi thành lục giác. Ở áp suất cao (vài GPa) xuất hiện một vài dạng tinh thể khác của CuCl.[5]
Đồng(I) chloride là một acid Lewis, được phân loại là "mềm" theo thuyết acid-base cứng-mềm (HSAB), do đó hợp chất này có thể tạo phức chất với các base Lewis "mềm" như triphenylphosphine:
- 4 CuCl + 4 P(C
6H
5)
3 → {CuCl[P(C
6H
5)
3]}
4 - CuCl + 2 P(C
6H
5)
3 → CuCl[P(C
6H
5)
3)]
2 - CuCl + 3 P(C
6H
5)
3 → CuCl[P(C
6H
5)
3)]
3
CuCl cũng tạo phức với halide. Ví dụ H
3O+
CuCl−
2 tạo thành acid hydrochloric đậm đặc.[15] Chloride bị CN−
và S
2O
32-
thay thế.[12]
Dung dịch CuCl trong HCl hấp thụ carbon monoxide để tạo thành các phức không màu như dimer chứa cầu chloride [CuCl(CO)]
2. Các dung dịch acid hydrochloric tương tự cũng phản ứng với khí acetylen tạo thành [CuCl(C
2H
2)]. Dung dịch amonia của CuCl phản ứng với acetylen tạo thành đồng(I) acetylide dễ nổ Cu
2C
2. Điều chế phức alken của CuCl bằng cách khử CuCl
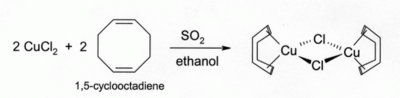
2 bằng lưu huỳnh dioxide có mặt của alken trong dung dịch alcohol. Các phức chất với dien như 1,5-cyclooctadien rất ổn định:[16]
Khi tiếp xúc với nước, đồng(I) chloride tự oxy hóa khử dần dần:[17]
- 2 CuCl → Cu + CuCl
2
Do có quá trình tự oxy hóa khử, các mẫu CuCl trong không khí có màu xanh lục.[18]
Ứng dụng[sửa | sửa mã nguồn]
Ứng dụng chính của đồng(I) chloride là tiền chất của thuốc diệt nấm đồng oxychloride[chú thích 1] (hay đồng trihydroxyl chloride). Với mục đích này, dung dịch đồng(I) chloride được tạo ra bằng phản ứng hợp phân (comproportionation hay synproportionation) và sau đó được oxy hóa trong không khí:[12]
- Cu + CuCl
2 → 2 CuCl - 4 CuCl + O
2 + 2 H
2O → Cu
3Cl
2(OH)
4 + CuCl
2
Đồng(I) chloride xúc tác cho nhiều phản ứng hữu cơ khác nhau như đã thảo luận ở trên. Ái lực của hợp chất với carbon monoxide khi có mặt nhôm chloride được khai thác trong quy trình COPureSM.[19]
Trong tổng hợp hữu cơ[sửa | sửa mã nguồn]
CuCl được sử dụng làm chất đồng xúc tác (co-catalyst) với carbon monoxide, nhôm chloride và hydro chloride trong phản ứng Gatterman-Koch để tạo thành benzaldehyde.[20]
Trong phản ứng Sandmeyer, việc xử lý muối arenediazoni bằng CuCl sẽ tạo ra aryl chloride. Ví dụ:[21][22]
Phản ứng có tính linh hoạt (được sử dụng để tổng hợp nhiều loại hợp chất hữu cơ khác nhau) và có hiệu suất tốt.[22]
Các nhà điều tra ban đầu đã quan sát thấy rằng đồng(I) halide xúc tác cho phản ứng cộng 1,4 của tác nhân Grignard thành ketone không bão hòa ở vị trí alpha, beta,[23] dẫn đến sự phát triển của tác nhân cơ-đồng được sử dụng rộng rãi ngày nay trong tổng hợp hữu cơ:[24]
Phát hiện này đã giúp mảng hóa hóa về hợp chất cơ-đồng phát triển. Ví dụ, CuCl phản ứng với methyllithi (CH
3Li) để tạo thành "tác nhân Gilman" như (CH
3)
2CuLi, được sử dụng trong tổng hợp hữu cơ. Tác nhân Grignard cũng tương tự tạo thành các hợp chất cơ-đồng. Mặc dù các hợp chất đồng(I) như đồng(I) iodide hiện nay thường được sử dụng cho các loại phản ứng này, trong một số phản ứng xúc tác đồng(I) chloride vẫn được khuyến nghị sử dụng:[25]
Ứng dụng khác[sửa | sửa mã nguồn]
CuCl được sử dụng làm chất xúc tác trong phương pháp trùng hợp gốc chuyển nhượng nguyên tử gốc tự do (ATRP).[chú thích 2] CuCl được dùng trong sản xuất pháo hoa để tạo màu xanh lam/xanh lục. Đốt đồng chloride cho ngọn lửa màu xanh lục như tất cả các hợp chất đồng khác.[28]
Xuất hiện trong tự nhiên[sửa | sửa mã nguồn]
Dạng tự nhiên của CuCl là khoáng vật nantokite, một loại khoáng vật hiếm.[29]
Xem thêm[sửa | sửa mã nguồn]
Chú thích[sửa | sửa mã nguồn]
- ^ Tên thương mại là Đồng oxyclorua
- ^ ATRP (Atom transfer radical polymerization) được Krzysztof Matyjaszewski và cộng sự nghiên cứu thành công vào năm 1995, là quá trình trùng hợp có kiểm soát theo cơ chế gốc tự do, gốc khơi mào sinh ra từ phản ứng thuận nghịch giữa chất khơi mào và phức kim loại chuyển tiếp.[26][27]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e f Haynes, William M. biên tập (2011). CRC Handbook of Chemistry and Physics (ấn bản 92). Boca Raton, FL: CRC Press. tr. 4.61. ISBN 1439855110.
- ^ Garro, Núria; Cantarero, Andrés; Cardona, Manuel; Ruf, Tobias; Göbel, Andreas; Lin, Chengtian; Reimann, Klaus; Rübenacke, Stefan; Steube, Markus (1996). “Electron-phonon interaction at the direct gap of the copper halides”. Solid State Communications. 98 (1): 27–30. Bibcode:1996SSCom..98...27G. doi:10.1016/0038-1098(96)00020-8.
- ^ Haynes, William M. biên tập (2011). CRC Handbook of Chemistry and Physics (ấn bản 92). Boca Raton, FL: CRC Press. tr. 4.132. ISBN 1439855110.
- ^ Patnaik, Pradyot (2002) Handbook of Inorganic Chemicals. McGraw-Hill, ISBN 0-07-049439-8
- ^ a b Hull, S.; Keen, D. A. (1994). “High-pressure polymorphism of the copper(I) halides: A neutron-diffraction study to ~10 GPa”. Physical Review B. 50 (9): 5868–5885. Bibcode:1994PhRvB..50.5868H. doi:10.1103/PhysRevB.50.5868. PMID 9976955.
- ^ a b c “NIOSH Pocket Guide to Chemical Hazards #0150”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Boyle, Robert (1666). Considerations and experiments about the origin of forms and qualities. Oxford. tr. 286–288.
- ^ Proust, J. L. (1799). “Recherches sur le Cuivre”. Ann. Chim. Phys. 32: 26–54.
- ^ Martin, Geoffrey (1922). Industrial and Manufacturing Chemistry . London: Crosby Lockwood. tr. 408.
- ^ Lewes, Vivian H. (1891). “The Analysis of Illuminationg Gases”. Journal of the Society of Chemical Industry. 10: 407–413.
- ^ Richardson, H. W. (2003). “Copper Compounds”. Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.0315161618090308.a01.pub2. ISBN 0471238961.
- ^ a b c d Zhang, J.; Richardson, H. W. (2016). “Copper Compounds”. Ullmann's Encyclopedia of Industrial Chemistry. tr. 1–31. doi:10.1002/14356007.a07_567.pub2. ISBN 978-3-527-30673-2.
- ^ Glemser, O.; Sauer, H. (1963). “Copper(I) Chloride”. Trong Brauer, G. (biên tập). Handbook of Preparative Inorganic Chemistry. 1 (ấn bản 2). New York: Academic Press. tr. 1005.
- ^ Tuğba Akbıyık; İnci Sönmezoğlu; Kubilay Güçlü; İzzet Tor; Reşat Apak (2012). “Protection of Ascorbic Acid from Copper(II)−Catalyzed Oxidative Degradation in the Presence of Fruit Acids: Citric, Oxalic, Tartaric, Malic, Malonic, and Fumaric Acids”. International Journal of Food Properties (bằng tiếng Anh). 15 (2): 398–411. doi:10.1080/10942912.2010.487630.
- ^ J. J. Fritz (1980). “Chloride complexes of copper(I) chloride in aqueous solution”. J. Phys. Chem. (bằng tiếng Anh). 84 (18): 2241–2246. doi:10.1021/j100455a006.
- ^ Nicholls, D. (1973) Complexes and First-Row Transition Elements, Macmillan Press, London.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ấn bản 2), Oxford: Butterworth-Heinemann, tr. 1185, ISBN 0-7506-3365-4
- ^ Pastor, Antonio C. (1986) Bằng sáng chế Hoa Kỳ số 4.582.579 "Method of preparing cupric ion free cuprous chloride" Section 2, lines 4–41.
- ^ Xiaozhou Ma; Jelco Albertsma; Dieke Gabriels; Rens Horst; Sevgi Polat; Casper Snoeks; Freek Kapteijn; Hüseyin Burak Eral; David A. Vermaas; Bastian Mei; Sissi de Beer (2023). “Carbon monoxide separation: past, present and future”. Chemical Society Reviews (bằng tiếng Anh). 52 (11): 3741–3777. doi:10.1039/D3CS00147D. PMC 10243283. PMID 37083229.
- ^ Dilke, M. H.; Eley, D. D. (1949). “550. The Gattermann–Koch reaction. Part II. Reaction kinetics”. J. Chem. Soc. (bằng tiếng Anh): 2613–2620. doi:10.1039/JR9490002613. ISSN 0368-1769.
- ^ Wade, L. G. (2003) Organic Chemistry, 5th ed.
- ^ a b March, J. (1992) Advanced Organic Chemistry, 4th ed.
- ^ Kharasch, M. S.; Tawney, P. O. (1941). “Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide”. J. Am. Chem. Soc. 63 (9): 2308. doi:10.1021/ja01854a005.
- ^ Jasrzebski, J. T. B. H.; van Koten, G. (2002) Modern Organocopper Chemistry, N. Krause (ed.).
- ^ Bertz, S. H.; Fairchild, E. H. (1999) Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, R. M. Coates, S. E. Denmark (eds.).
- ^ “Bài giảng tổng quan về ATRP”. Truy cập ngày 3 tháng 1 năm 2024.
- ^ Tsarevsky, Nicolay V.; Matyjaszewski, Krzysztof (4 tháng 4 năm 2013). “Atom Transfer Radical Polymerization (ATRP)”. Royal Society of Chemistry (bằng tiếng Anh). doi:10.1039/9781849737425-00287.
- ^ Barrow, R F; Caldin, E F (1 tháng 1 năm 1949). “Some Spectroscopic Observations on Pyrotechnic Flames”. Proceedings of the Physical Society. Section B. 62 (1): 32–39. doi:10.1088/0370-1301/62/1/305. ISSN 0370-1301.
- ^ “Nantokite”. Hudson Institute of Mineralogy. Truy cập ngày 26 tháng 1 năm 2024.
Liên kết ngoài[sửa | sửa mã nguồn]
- Kiểm kê chất ô nhiễm quốc gia - Tờ thông tin về đồng và hợp chất
- Quy trình COPureSM để tinh chế CO bằng cách sử dụng phức đồng chloride