Đồng(I) iodide
| Đồng(I) iodide | |
|---|---|
 Mẫu đồng(I) iodide | |
| Danh pháp IUPAC | Đồng(I) iodide |
| Tên khác | Cuprơ iodide Đồng monoiodide Cuprum(I) iodide Cuprum monoiodide |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | CuI |
| Khối lượng mol | 190,45 g/mol |
| Bề ngoài | bột trắng, khi không tinh khiết: màu nâu |
| Mùi | không mùi |
| Khối lượng riêng | 5,67 g/cm³[1] |
| Điểm nóng chảy | 606 °C (879 K; 1.123 °F) |
| Điểm sôi | 1.290 °C (1.560 K; 2.350 °F) (phân hủy) |
| Độ hòa tan trong nước | 4,2 mg/100 mL |
| Tích số tan, Ksp | 1×10-12 [2] |
| Độ hòa tan | tan trong amonia và kali hydroxide không tan trong axit loãng tạo phức với thiourê |
| Áp suất hơi | 10 mm Hg (656 ℃) |
| MagSus | -63,0·10-6 cm³/mol |
| Chiết suất (nD) | 2,346 |
| Cấu trúc | |
| Cấu trúc tinh thể | pha trộn kẽm |
| Các nguy hiểm | |
| NFPA 704 |
|
| Điểm bắt lửa | không bắt lửa |
| PEL | TWA 1 mg/m³ (tính theo Cu)[3] |
| REL | TWA 1 mg/m³ (tính theo Cu)[3] |
| IDLH | TWA 100 mg/m³ (tính theo Cu)[3] |
| Ký hiệu GHS |   |
| Chỉ dẫn nguy hiểm GHS | H302, H315, H319, H335, H410 |
| Chỉ dẫn phòng ngừa GHS | P261, P273, P305+P351+P338, P501 |
| Các hợp chất liên quan | |
| Anion khác | Đồng(I) fluoride Đồng(I) chloride Đồng(I) bromide |
| Cation khác | Bạc iodide Vàng(I) iodide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Đồng(I) iodide là hợp chất vô cơ, có công thức hóa học là CuI. Nó có ứng dụng trong nhiều việc khác nhau như để tổng hợp hữu cơ.
Đồng(I) iodide có màu trắng, khi được tìm thấy trong tự nhiên nó là chất khoáng thô hiếm, màu nâu đỏ, nhưng màu đó là do bị pha trộn lẫn tạp chất. Thường các hợp chất có chứa iodide bị đổi màu do sự oxy hóa iodide đối với phân tử iod.
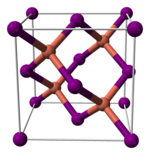
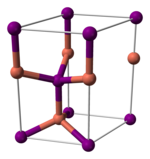
Cấu trúc[sửa | sửa mã nguồn]
Đồng(I) iodide, giống như hầu hết halide kim loại khác, là một polyme vô cơ. Nó tồn tại dưới nhiều dạng tinh thể. Nó có cấu trúc pha trộn kẽm dưới 390 ℃ (γ-CuI), cấu trúc wurtzit giữa 390 và 440 ℃ (β-CuI), và cấu trúc muối đá trên 440 ℃ (α-CuI). Các ion được phối hợp tứ diện khi ở dạng blend kẽm hoặc cấu trúc wurtzit, với khoảng cách Cu-I là 2,338 Å. Đồng(I) bromide và đồng(I) chloride cũng chuyển đổi từ cấu trúc blende kẽm sang cấu trúc wurtzit ở 405 và 435 ℃, tương ứng. Do đó, chiều dài liên kết đồng-halide càng dài, nhiệt độ cần để thay đổi cấu trúc từ cấu trúc pha trộn kẽm đến cấu trúc wurtzit càng thấp. Khoảng cách liên kết trong đồng(I) bromide và đồng(I) chloride tương ứng là 2,173 và 2,051 Å[4].
 |
 |
 |
Điều chế[sửa | sửa mã nguồn]
Đồng(I) iodide có thể được điều chế bằng cách đốt nóng iod và đồng trong HI. Tuy nhiên, trong phòng thí nghiệm, đồng(I) iodide được điều chế bằng cách trộn một dung dịch nước của natri hoặc kali iodide và một muối đồng(II) tan như đồng(II) sunfat.
- Cu2+ + 2I− → CuI2
CuI2 ngay lập tức phân hủy tạo thành CuI và giải phóng I2:[5]
- 2CuI2 → 2CuI + I2
Tính chất[sửa | sửa mã nguồn]
CuI có thể hòa tan trong MeCN.
Sử dụng[sửa | sửa mã nguồn]
- CuI được sử dụng làm chất thử trong tổng hợp hữu cơ. Kết hợp với các hợp chất diamin 1,2 hoặc 1,3, CuI xúc tác chuyển hóa aryl-, heteroaryl-, và vinyl-bromide thành các iodid tương ứng.
- CuI được sử dụng như là một nguồn iod ăn kiêng trong muối ăn và thức ăn chăn nuôi[6].
- Các đặc tính cấu trúc của CuI cho phép CuI ổn định nhiệt trong nylon trong ngành công nghiệp thảm thương mại và nhà ở, các phụ kiện động cơ ô tô và các thị trường khác, nơi cần yếu tố độ bền và trọng lượng.
- CuI được sử dụng trong việc phát hiện thủy ngân. Khi tiếp xúc với hơi nước thủy ngân, hợp chất trắng ban đầu thay đổi màu sắc để tạo thành đồng tetraiodomercurat, có màu nâu.
- CuI được sử dụng trong việc thiết kế và tổng hợp các cụm Cu(I)[7], đó là hợp chất phức tạp polymetal.
- CuI được dùng để thay đổi lượng mưa hoặc cấu trúc của chúng bằng cách phân tán các chất vào khí quyển làm tăng khả năng nước tạo thành các giọt nhỏ hoặc tinh thể.
Hợp chất khác[sửa | sửa mã nguồn]
CuI còn tạo một số hợp chất với NH3, như:
- CuI·3NH3 – chất rắn lục nhạt;
- 2CuI·3NH3 – chất rắn nâu đen.
Hợp chất CuI·3NH3 tồn tại dưới trạng thái đime.[8]
CuI còn tạo một số hợp chất với CS(NH2)2, như CuI·CS(NH2)2 là tinh thể trắng[9] hay CuI·3CS(NH2)2 là tinh thể lục phương trong suốt giống nước, bị phân hủy bởi nước.[10]
Tham khảo[sửa | sửa mã nguồn]
- ^ Lide, David R. biên tập (2006). CRC Handbook of Chemistry and Physics (ấn bản 87). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ Skoog West Holler Crouch. Fundamentals of Inorganic Chemistry. Brooks/Cole, 2004, pp. A-6 ISBN 978-0-03-035523-3
- ^ a b c “NIOSH Pocket Guide to Chemical Hazards #0150”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Wells, A. F. Structural Inorganic Chemistry Oxford University Press, Oxford, (1984). 5th ed., tr. 410 và 444.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ H. W. Richardson "Copper Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_567
- ^ http://pubs.acs.org/doi/abs/10.1021/acs.chemmater.7b01790
- ^ A Text-book Of Inorganic Chemistry Vol-x, trang 35 – [1]. Truy cập 16 tháng 3 năm 2020.
- ^ Senyun Ye, Haixia Rao, Ziran Zhao, Linjuan Zhang, Hongliang Bao, Weihai Sun, Yunlong Li, Feidan Gu, Jianqiang Wang, Zhiwei Liu, Zuqiang Bian, Chunhui Huang – A Breakthrough Efficiency of 19.9% Obtained in Inverted Perovskite Solar Cells by Using an Efficient Trap State Passivator Cu(thiourea)I. J. Am. Chem. Soc. 2017, 139, 22, 7504–7512 (ngày 14 tháng 5 năm 2017). doi:10.1021/jacs.7b01439.
- ^ Gmelin-Kraut's Handbuch der anorganischen chemie... unter mitwirkung hervorragender fachgenossen (Gmelin, Leopold, 1788-1853; Kraut, Karl Johann, 1829-1912), trang 1073. Truy cập 3 tháng 3 năm 2021.
| HI | He | ||||||||||||||||
| LiI | BeI2 | BI3 | CI4 | NI3 | I2O4, I2O5, I4O9 |
IF, IF3, IF5, IF7 |
Ne | ||||||||||
| NaI | MgI2 | AlI3 | SiI4 | PI3, P2I4 |
S | ICl, ICl3 |
Ar | ||||||||||
| KI | CaI2 | ScI3 | TiI2, TiI3, TiI4 |
VI2, VI3, VOI2 |
CrI2, CrI3, CrI4 |
MnI2 | FeI2, FeI3 |
CoI2 | NiI2 | CuI, CuI2 |
ZnI2 | GaI, GaI2, GaI3 |
GeI2, GeI4 |
AsI3 | Se | IBr | Kr |
| RbI | SrI2 | YI3 | ZrI2, ZrI4 |
NbI2, NbI3, NbI4, NbI5 |
MoI2, MoI3, MoI4 |
TcI3, TcI4 |
RuI2, RuI3 |
RhI3 | PdI2 | AgI | CdI2 | InI3 | SnI2, SnI4 |
SbI3 | TeI4 | I | Xe |
| CsI | BaI2 | HfI4 | TaI3, TaI4, TaI5 |
WI2, WI3, WI4 |
ReI, ReI2, ReI3, ReI4 |
OsI, OsI2, OsI3 |
IrI, IrI2, IrI3 |
PtI2, PtI3, PtI4 |
AuI,AuI3 | Hg2I2, HgI2 |
TlI, TlI3 |
PbI2, PbI4 |
BiI2, BiI3 |
PoI2. PoI4 |
AtI | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| LaI2, LaI3 |
CeI2, CeI3 |
PrI2, PrI3 |
NdI2, NdI3 |
PmI3 | SmI2, SmI3 |
EuI2, EuI3 |
GdI2, GdI3 |
TbI3 | DyI2, DyI3 |
HoI3 | ErI3 | TmI2, TmI3 |
YbI2, YbI3 |
LuI3 | |||
| Ac | ThI2, ThI3, ThI4 |
PaI3, PaI4, PaI5 |
UI3, UI4, UI5 |
NpI3 | PuI3 | AmI2, AmI3 |
CmI2, CmI3 |
BkI3 | CfI2, CfI3 |
EsI3 | Fm | Md | No | Lr | |||


