Khác biệt giữa bản sửa đổi của “Kẽm”
→Ứng dụng: dịch |
|||
| Dòng 76: | Dòng 76: | ||
Với một thế điện cực chuẩn (SEP) 0,76 vôn, kẽm được sử dụng làm vật liệu anot cho pin. Bột kẽm được sử dụng theo cách này trong các loại pin kiềm và các tấm kẽm kim loại tạo thành vỏ bọc và cũng là anot trong pin kẽm-carbon.<ref>{{Cite book|first=Jürgen O.|last=Besenhard|title=Handbook of Battery Materials|accessdate=2008-10-08|publisher=Wiley-VCH|url=http://www.ulb.tu-darmstadt.de/tocs/60178752.pdf|isbn=3-527-29469-4|year=1999}}</ref><ref>{{Cite journal|doi=10.1016/0378-7753(95)02242-2|year=1995|title=Recycling zinc batteries: an economical challenge in consumer waste management|first=J. -P.|last=Wiaux|coauthors=Waefler, J. -P.|journal=Journal of Power Sources|volume=57|issue=1–2|page=61}}</ref> Kẽm được sử dụng làm anot hoặc nhiên liệu cho tế bào nhiêu liệu kẽm/pin kẽm-không khí.<ref>{{Cite journal|title=A design guide for rechargeable zinc-air battery technology|last=Culter|first=T.|doi=10.1109/SOUTHC.1996.535134|journal=Southcon/96. Conference Record|isbn=0-7803-3268-7|year=1996|page=616}}</ref><ref>{{cite web|url=http://www.electric-fuel.com/evtech/papers/paper11-1-98.pdf| title=Zinc Air Battery-Battery Hybrid for Powering Electric Scooters and Electric Buses|first=Jonathan|last=Whartman|coauthors=Brown, Ian|publisher=The 15th International Electric Vehicle Symposium| accessdate=2008-10-08}}</ref><ref>{{cite web|url =http://www.osti.gov/energycitations/product.biblio.jsp?osti_id=82465|title=A refuelable zinc/air battery for fleet electric vehicle propulsion|last=Cooper|first=J. F|coauthors=Fleming, D.; Hargrove, D.; Koopman, R.; Peterman, K|publisher=Society of Automotive Engineers future transportation technology conference and exposition|accessdate=2008-10-08}}</ref> |
Với một thế điện cực chuẩn (SEP) 0,76 vôn, kẽm được sử dụng làm vật liệu anot cho pin. Bột kẽm được sử dụng theo cách này trong các loại pin kiềm và các tấm kẽm kim loại tạo thành vỏ bọc và cũng là anot trong pin kẽm-carbon.<ref>{{Cite book|first=Jürgen O.|last=Besenhard|title=Handbook of Battery Materials|accessdate=2008-10-08|publisher=Wiley-VCH|url=http://www.ulb.tu-darmstadt.de/tocs/60178752.pdf|isbn=3-527-29469-4|year=1999}}</ref><ref>{{Cite journal|doi=10.1016/0378-7753(95)02242-2|year=1995|title=Recycling zinc batteries: an economical challenge in consumer waste management|first=J. -P.|last=Wiaux|coauthors=Waefler, J. -P.|journal=Journal of Power Sources|volume=57|issue=1–2|page=61}}</ref> Kẽm được sử dụng làm anot hoặc nhiên liệu cho tế bào nhiêu liệu kẽm/pin kẽm-không khí.<ref>{{Cite journal|title=A design guide for rechargeable zinc-air battery technology|last=Culter|first=T.|doi=10.1109/SOUTHC.1996.535134|journal=Southcon/96. Conference Record|isbn=0-7803-3268-7|year=1996|page=616}}</ref><ref>{{cite web|url=http://www.electric-fuel.com/evtech/papers/paper11-1-98.pdf| title=Zinc Air Battery-Battery Hybrid for Powering Electric Scooters and Electric Buses|first=Jonathan|last=Whartman|coauthors=Brown, Ian|publisher=The 15th International Electric Vehicle Symposium| accessdate=2008-10-08}}</ref><ref>{{cite web|url =http://www.osti.gov/energycitations/product.biblio.jsp?osti_id=82465|title=A refuelable zinc/air battery for fleet electric vehicle propulsion|last=Cooper|first=J. F|coauthors=Fleming, D.; Hargrove, D.; Koopman, R.; Peterman, K|publisher=Society of Automotive Engineers future transportation technology conference and exposition|accessdate=2008-10-08}}</ref> |
||
{{Đang dịch 2 (nguồn)|ngày=4 |
|||
|tháng=04 |
|||
|năm=2013 |
|||
|1 = |
|||
}} |
|||
===Hợp kim=== |
|||
A widely used alloy which contains zinc is brass, in which copper is alloyed with anywhere from 3% to 45% zinc, depending upon the type of brass.<ref name="Lehto1968p829"/> Brass is generally more [[ductile]] and stronger than copper and has superior [[corrosion resistance]].<ref name="Lehto1968p829"/> These properties make it useful in communication equipment, hardware, musical instruments, and water valves.<ref name="Lehto1968p829"/> |
|||
[[File:Macrostructure of rolled and annealed brass; magnification 400X.jpg|thumb|left|Cast brass microstructure at magnification 400x|alt=A mosaica pattern composed of components having various shapes and shades of brown.]] |
|||
Other widely used alloys that contain zinc include [[nickel silver]], typewriter metal, soft and aluminium [[solder]], and commercial [[bronze]].<ref name="CRCp4-41"/> Zinc is also used in contemporary pipe organs as a substitute for the traditional lead/tin alloy in pipes.<ref>{{Cite book|first=Douglas Earl|last=Bush|coauthor=Kassel, Richard|title=The Organ: An Encyclopedia|isbn=978-0-415-94174-7|url=http://books.google.com/?id=cgDJaeFFUPoC|publisher=Routledge|year=2006|page=679}}</ref> Alloys of 85–88% zinc, 4–10% copper, and 2–8% aluminium find limited use in certain types of machine bearings. Zinc is the primary metal used in making [[Lincoln cent|American one cent coins]] since 1982.<ref name="onecent">{{cite web|url=http://www.usmint.gov/about_the_mint/?action=coin_specifications|publisher=United States Mint|accessdate=2008-10-08|title=Coin Specifications}}</ref> The zinc core is coated with a thin layer of copper to give the impression of a copper coin. In 1994, {{convert|33200|t|ST}} of zinc were used to produce 13.6 billion pennies in the United States.<ref name="USGS-yb1994">{{cite web|url=http://minerals.usgs.gov/minerals/pubs/commodity/zinc/720494.pdf|publisher=United States Geological Survey|title=Mineral Yearbook 1994: Zinc|first=Stephen M|last=Jasinski|accessdate=2008-11-13}}</ref> |
|||
Alloys of primarily zinc with small amounts of copper, aluminium, and magnesium are useful in [[die casting]] as well as [[spin casting]], especially in the automotive, electrical, and hardware industries.<ref name="CRCp4-41"/> These alloys are marketed under the name [[Zamak]].<ref>{{cite web|url=http://www.eazall.com/diecastalloys.aspx|title=Diecasting Alloys|author=Eastern Alloys contributors|publisher=Eastern Alloys|accessdate=2009-01-19|location=Maybrook, NY}}</ref> An example of this is [[zinc aluminium]]. The low melting point together with the low [[viscosity]] of the alloy makes the production of small and intricate shapes possible. The low working temperature leads to rapid cooling of the cast products and therefore fast assembly is possible.<ref name="CRCp4-41"/><ref>{{Cite journal|first=D.|last=Apelian|coauthors=Paliwal, M.; Herrschaft, D. C.|title=Casting with Zinc Alloys|journal=Journal of Metals|volume=33|year=1981|pages =12–19}}</ref> Another alloy, marketed under the brand name Prestal, contains 78% zinc and 22% aluminium and is reported to be nearly as strong as steel but as malleable as plastic.<ref name="CRCp4-41"/><ref>{{Cite book|url=http://books.google.com/?id=s0i32LSfrJ4C&pg=PA157|page=157|title=Materials for automobile bodies|author=Davies, Geoff|publisher=Butterworth-Heinemann|year=2003|isbn=0-7506-5692-1}}</ref> This [[superplasticity]] of the alloy allows it to be molded using die casts made of ceramics and cement.<ref name="CRCp4-41"/> |
|||
Similar alloys with the addition of a small amount of lead can be cold-rolled into sheets. An alloy of 96% zinc and 4% aluminium is used to make stamping dies for low production run applications for which ferrous metal dies would be too expensive.<ref name="samans">{{Cite book|last=Samans|first=Carl Hubert|title=Engineering Metals and Their Alloys|publisher=Macmillan Co|year=1949}}</ref> In building facades, roofs or other applications in which zinc is used as [[sheet metal]] and for methods such as [[deep drawing]], [[roll forming]] or [[bending (metalworking)|bending]], zinc alloys with [[titanium]] and copper are used.<ref name="ZincCorr">{{Cite book|url=http://books.google.com/?id=C-pAiedmqp8C|title=Corrosion Resistance of Zinc and Zinc Alloys|first=Frank|last=Porter|publisher =CRC Press|year=1994|isbn=978-0-8247-9213-8|chapter=Wrought Zinc|pages=6–7}}</ref> Unalloyed zinc is too brittle for these kinds of manufacturing processes.<ref name="ZincCorr"/> |
|||
As a dense, inexpensive, easily worked material, zinc is used as a [[lead]] replacement. In the wake of [[Lead poisoning|lead concerns]], zinc appears in weights for various applications ranging from fishing<ref>{{cite book|author=McClane, Albert Jules and Gardner, Keith |title=The Complete book of fishing: a guide to freshwater, saltwater & big-game fishing|url=http://books.google.com/books?id=b3nWAAAAMAAJ|accessdate=26 June 2012|year=1987|publisher=Gallery Books|isbn=978-0-8317-1565-6}}</ref> to [[tire balance]]s and flywheels.<ref name="minrecall">{{cite web | url=http://www.minourausa.com/english/support-e/recall-e.html |
|||
| title=Cast flywheel on old Magturbo trainer has been recalled since July 2000|work=Minoura}}</ref> |
|||
[[Cadmium zinc telluride]] (CZT) is a [[semiconductor|semiconductive]] alloy that can be divided into an array of small sensing devices.<ref name="Katz2002"/> These devices are similar to an [[integrated circuit]] and can detect the energy of incoming [[gamma ray]] photons.<ref name="Katz2002"/> When placed behind an absorbing mask, the CZT sensor array can also be used to determine the direction of the rays.<ref name="Katz2002">{{Cite book| title=The Biggest Bangs|last=Katz|first=Johnathan I.|page=18|publisher=[[Oxford University Press]]|year=2002|isbn=0-19-514570-4}}</ref> |
|||
===Các ứng dụng công nghiệp khác=== |
|||
[[File:Zinc oxide.jpg|thumb|Zinc oxide is used as a white [[pigment]] in [[paint]]s.|alt=White powder on a glass plate]] |
|||
Roughly one quarter of all zinc output in the United States (2009), is consumed in the form of zinc compounds;<ref name="USGS-yb2006"/> a variety of which are used industrially. Zinc oxide is widely used as a white pigment in paints, and as a [[catalyst]] in the manufacture of rubber. It is also used as a heat disperser for the rubber and acts to protect its polymers from [[ultraviolet radiation]] (the same UV protection is conferred to plastics containing zinc oxide).<ref name="Emsley2001p503"/> The [[semiconductor]] properties of zinc oxide make it useful in [[varistor]]s and photocopying products.<ref>{{Cite book|last=Zhang|first=Xiaoge Gregory|title=Corrosion and Electrochemistry of Zinc|publisher=Springer|year=1996|page=93|isbn=0-306-45334-7|url=http://books.google.com/?id=Qmf4VsriAtMC}}</ref> The [[zinc zinc-oxide cycle]] is a two step [[Thermochemistry|thermochemical]] process based on zinc and zinc oxide for [[hydrogen production]].<ref>{{cite web|url=http://www.hydrogen.energy.gov/pdfs/review06/pd_10_weimer.pdf|title=Development of Solar-powered Thermochemical Production of Hydrogen from Water|last=Weimer|first=Al|date=2006-05-17|accessdate=2009-01-10|publisher=[[U.S. Department of Energy]]}}</ref> |
|||
[[Zinc chloride]] is often added to lumber as a [[fire retardant]]<ref name="Heiserman1992p124">{{harvnb|Heiserman|1992|p=124}}</ref> and can be used as a wood [[preservative]].<ref>{{cite web|title=Wood preservatives|last=Blew|first=Joseph Oscar|year=1953|publisher=Department of Agriculture, Forest Service, Forest Products Laboratory|url=http://ir.library.oregonstate.edu/xmlui/bitstream/handle/1957/816/FPL_D149ocr.pdf|id={{hdl|1957/816}}}}</ref> It is also used to make other chemicals.<ref name="Heiserman1992p124"/> [[Zinc methyl]] ({{chem|Zn(CH<sub>3</sub>)|2}}) is used in a number of organic [[organic synthesis|syntheses]].<ref>{{Cite journal|first=Edward|last=Frankland|authorlink=Edward Frankland|journal=[[Liebigs Annalen|Liebig's Annalen der Chemie und Pharmacie]]|title=Notiz über eine neue Reihe organischer Körper, welche Metalle, Phosphor u. s. w. enthalten|year=1849|volume=71|issue=2|page=213|doi=10.1002/jlac.18490710206|language=German}}</ref> [[Zinc sulfide]] (ZnS) is used in [[luminescence|luminescent]] pigments such as on the hands of clocks, [[X-ray]] and television screens, and [[luminous paint]]s.<ref name="CRCp4-42">{{harvnb|CRC|2006|p='''4'''-42<!-- sic "hyphen -" ; not a range!-->}}</ref> Crystals of ZnS are used in [[laser]]s that operate in the mid-[[infrared]] part of the spectrum.<ref>{{Cite book|last=Paschotta|first=Rüdiger|title=Encyclopedia of Laser Physics and Technology|publisher=Wiley-VCH|year=2008|page=798|isbn=3-527-40828-2|url=http://books.google.com/?id=BN026ye2fJAC}}</ref> [[Zinc sulfate]] is a chemical in [[dye]]s and pigments.<ref name="Heiserman1992p124"/> [[Zinc pyrithione]] is used in [[antifouling]] paints.<ref>{{Cite journal|journal=Environment International|volume=30|year=2004|issue=2|page=235|doi=10.1016/S0160-4120(03)00176-4|title=Worldwide occurrence and effects of antifouling paint booster biocides in the aquatic environment: a review|first=I. K.|last=Konstantinou|coauthors=Albanis, T. A.}}</ref> |
|||
Zinc powder is sometimes used as a [[propellant]] in [[model rocket]]s.<ref name="ZnS"/> When a compressed mixture of 70% zinc and 30% [[sulfur]] powder is ignited there is a violent chemical reaction.<ref name="ZnS"/> This produces zinc sulfide, together with large amounts of hot gas, heat, and light.<ref name="ZnS">{{cite web|url=http://www.angelo.edu/faculty/kboudrea/demos/zinc_sulfur/zinc_sulfur.htm|title=Zinc + Sulfur|last=Boudreaux|first=Kevin A|publisher=Angelo State University|accessdate=2008-10-08}}</ref> Zinc sheet metal is used to make zinc [[bar (counter)|bars]].<ref>{{cite web|title=Technical Information|year=2008|publisher=Zinc Counters| url=http://www.zinccounters.co.uk/html/tech/tech.htm|accessdate=2008-11-29}}</ref> |
|||
{{chem|64|Zn}}, the most abundant isotope of zinc, is very susceptible to [[neutron activation]], being [[Nuclear transmutation|transmuted]] into the highly radioactive {{chem|65|Zn}}, which has a half-life of 244 days and produces intense [[gamma ray|gamma radiation]]. Because of this, Zinc Oxide used in nuclear reactors as an anti-corrosion agent is depleted of {{chem|64|Zn}} before use, this is called [[depleted zinc oxide]]. For the same reason, zinc has been proposed as a [[Salted bomb|salting]] material for [[nuclear weapon]]s ([[cobalt]] is another, better-known salting material).<ref name="Win2003"/> A jacket of [[Isotope separation|isotopically enriched]] {{chem|64|Zn}} would be irradiated by the intense high-energy neutron flux from an exploding thermonuclear weapon, forming a large amount of {{chem|65|Zn}} significantly increasing the radioactivity of the weapon's [[Nuclear fallout|fallout]].<ref name="Win2003"/> Such a weapon is not known to have ever been built, tested, or used.<ref name="Win2003">{{Cite journal|title=Weapons of Mass Destruction|first=David Tin|last=Win|coauthors=Masum, Al|url=http://www.journal.au.edu/au_techno/2003/apr2003/aujt6-4_article07.pdf|year=2003|journal=Assumption University Journal of Technology|volume=6|issue=4|page=199|publisher=Assumption University|accessdate=2009-04-06}}</ref> {{chem|65|Zn}} is also used as a [[isotopic tracer|tracer]] to study how alloys that contain zinc wear out, or the path and the role of zinc in organisms.<ref>{{cite book|url=http://www.encyclopedia.com/doc/1G2-3427000114.html|isbn=0-7876-2846-8|publisher=U. X. L. /Gale|year=1999|title=Chemical Elements: From Carbon to Krypton|author=David E. Newton|accessdate=2009-04-06}}</ref> |
|||
Zinc dithiocarbamate complexes are used as agricultural [[fungicide]]s; these include [[Zineb]], Metiram, Propineb and Ziram.<ref>{{Cite book|url=http://books.google.com/?id=cItuoO9zSjkC&pg=PA591|title=Ullmann's Agrochemicals|year=2007|publisher=Wiley-Vch (COR)|isbn=3-527-31604-3|pages=591–592}}</ref> Zinc naphthenate is used as wood preservative.<ref>{{Cite book|title=Primary Wood Processing: Principles and Practice| last=Walker|first =J. C. F.|year=2006|publisher=Springer|isbn=1-4020-4392-9|page=317}}</ref> Zinc, in the form of [[Zinc dithiophosphate|ZDDP]], is also used as an anti-wear additive for metal parts in engine oil.<ref>{{cite web|title=ZDDP Engine Oil – The Zinc Factor|url=http://www.mustangmonthly.com/techarticles/mump_0907_zddp_zinc_additive_engine_oil/index.html|publisher=Mustang Monthly|accessdate=2009-09-19}}</ref> |
|||
===Bổ sung trong khẩu phần ăn=== |
|||
[[File:Zinc 50 mg.jpg|thumb|175px|[[General Nutrition Centers|GNC]] zinc 50 mg tablets ([[Australia|AU]])]] |
|||
Zinc is included in most single tablet over-the-counter daily vitamin and [[Dietary mineral|mineral]] supplements.<ref name="DiSilvestro2004">{{Cite book|last=DiSilvestro|first=Robert A.|title=Handbook of Minerals as Nutritional Supplements|year=2004|publisher=CRC Press|pages=135, 155|isbn=0-8493-1652-9}}</ref> Preparations include zinc oxide, zinc acetate, and [[zinc gluconate]].<ref name="DiSilvestro2004"/> It is believed to possess [[antioxidant]] properties, which may protect against accelerated aging of the skin and muscles of the body; studies differ as to its effectiveness.<ref name="Milbury2008">{{Cite book|last=Milbury|first=Paul E.|coauthors=Richer, Alice C.| title=Understanding the Antioxidant Controversy: Scrutinizing the "fountain of Youth"|page=99|publisher=Greenwood Publishing Group|isbn=0-275-99376-0|year=2008}}</ref> Zinc also helps speed up the healing process after an injury.<ref name="Milbury2008"/> It is also beneficial to the body's immune system. Indeed, zinc deficiency may have effects on virtually all parts of the human immune system.<ref>{{cite journal|pmid=2200472|year=1990|last1=Keen|first1=CL|last2=Gershwin|first2=ME|title=Zinc deficiency and immune function|volume=10|pages=415–31|doi=10.1146/annurev.nu.10.070190.002215|journal=Annual review of nutrition}}</ref> |
|||
The efficacy of zinc compounds when used to reduce the duration or severity of [[Common cold|cold]] symptoms is [[Alternative treatments used for the common cold#Zinc preparations|controversial]].<ref>{{cite web |title=Zinc and Health : The Common Cold |url=http://ods.od.nih.gov/factsheets/zinc/#h7 |publisher=Office of Dietary Supplements, [[National Institutes of Health]] |accessdate=2010-05-01}}</ref> A 2011 [[systematic review]] concludes that supplementation yields a mild decrease in duration and severity of cold symptoms.<ref>{{Cite journal| author=Singh M, Das RR.| title=Zinc for the common cold|journal=Cochrane Database of Systematic Reviews| year=2011| issue=2| doi=10.1002/14651858.CD001364.pub3| pmid=21328251| volume=2| pages=CD001364| editor1-last=Singh| editor1-first=Meenu}}</ref> |
|||
Zinc serves as a simple, inexpensive, and critical tool for treating diarrheal episodes among children in the developing world. Zinc becomes depleted in the body during [[diarrhea]], but recent studies suggest that replenishing zinc with a 10- to 14-day course of treatment can reduce the duration and severity of diarrheal episodes and may also prevent future episodes for up to three months.<ref>{{cite journal|title=Therapeutic effects of oral zinc in acute and persistent diarrhea in children in developing countries: pooled analysis of randomized controlled trials|pmid=11101480|year=2000|last1=Bhutta|first1=ZA|last2=Bird|first2=SM|last3=Black|first3=RE|last4=Brown|first4=KH|last5=Gardner|first5=JM|last6=Hidayat|first6=A|last7=Khatun|first7=F|last8=Martorell|first8=R|last9=Ninh|first9=NX|volume=72|issue=6|pages=1516–22|journal=The American journal of clinical nutrition}}</ref> |
|||
[[File:Zinc gluconate structure.svg|thumb|left|[[Zinc gluconate]] is one compound used for the delivery of zinc as a [[dietary supplement]].|alt=Skeletal chemical formula of a planar compound featuring a Zn atom in the center, symmetrically bonded to four oxygens. Those oxygens are further connected to linear COH chains.]] |
|||
The [[Age-Related Eye Disease Study]] determined that zinc can be part of an effective treatment for [[age-related macular degeneration]].<ref>{{Cite journal|title=A Randomized, Placebo-Controlled, Clinical Trial of High-Dose Supplementation With Vitamins C and E, Beta Carotene, and Zinc for Age-Related Macular Degeneration and Vision Loss: AREDS Report No. 8|author=Age-Related Eye Disease Study Research Group|journal=Arch Ophthalmology|year=2001|volume=119|issue=10|pmid=11594942|pmc=1462955|pages=1417–36|doi=10.1001/archopht.119.10.1417}}</ref> Zinc supplementation is an effective treatment for [[acrodermatitis enteropathica]], a genetic disorder affecting zinc absorption that was previously fatal to babies born with it.<ref name="Emsley2001p501"/> |
|||
[[Gastroenteritis]] is strongly attenuated by ingestion of zinc, and this effect could be due to direct antimicrobial action of the zinc ions in the [[gastrointestinal tract]], or to the absorption of the zinc and re-release from immune cells (all [[granulocyte]]s secrete zinc), or both.<ref>{{cite journal|last=Aydemir|first=T. B.|coauthor=Blanchard, R. K.; Cousins, R. J.|year=2006|title=Zinc supplementation of young men alters metallothionein, zinc transporter, and cytokine gene expression in leukocyte populations|journal=PNAS|pmid=16434472|volume=103|issue=6|pmc=1413653|doi=10.1073/pnas.0510407103|bibcode = 2006PNAS..103.1699A|pages=1699–704 }}</ref><ref>{{cite journal|last=Valko|first=M.|coauthors=Morris, H.; Cronin, M. T. D.|year=2005|title=Metals, Toxicity and Oxidative stress|journal=Current Medicinal Chemistry|issue=10|volume=12|doi=10.2174/0929867053764635|pmid=15892631|pages=1161–208}}</ref><ref group=note>In [[clinical trial]]s, both zinc gluconate and zinc gluconate glycine (the formulation used in lozenges) have been shown to shorten the duration of symptoms of the common cold. |
|||
:{{cite journal|last=Godfrey|first=J. C.|coauthors=Godfrey, N. J.; Novick, S. G.|title=Zinc for treating the common cold: Review of all clinical trials since 1984|year=1996|pmid=8942045|journal=Alternative Therapies in Health and Medicine|volume=2|issue=6|pages=63–72}} |
|||
The amount of glycine can vary from two to twenty moles per mole of zinc gluconate. One review of the research found that out of nine controlled experiments using zinc lozenges, the results were positive in four studies, and no better than placebo in five. |
|||
:{{cite web|url=http://web.archive.org/web/20081222105854/http://www.uspharmacist.com/oldformat.asp?url=newlook/files/alte/feat2.htm| work=US Pharmacist|title=Zinc and the Common Cold: What Pharmacists Need to Know|last=Hulisz|first=Darrell T|publisher=uspharmacist.com|accessdate=2012-04-09}} |
|||
This review also suggested that the research is characterized by methodological problems, including differences in the dosage amount used, and the use of self-report data. The evidence suggests that zinc supplements may be most effective if they are taken at the first sign of cold symptoms.</ref> |
|||
In 2011, researchers at [[John Jay College of Criminal Justice]] reported that dietary zinc supplements can mask the presence of drugs in urine. Similar claims have been made in web forums on that topic.<ref>{{cite journal|last=Venkatratnam|first=Abhishek|coauthors=Nathan Lents|title=Zinc Reduces the Detection of Cocaine, Methamphetamine, and THC by ELISA Urine Testing|journal=Journal of Analytical Toxicology|date=1 July 2011|volume=35|issue=6|pages=333–340|pmid=21740689|url=http://www.ingentaconnect.com/content/pres/jat/2011/00000035/00000006/art00002|doi=10.1093/anatox/35.6.333}}</ref> |
|||
Although not yet tested as a therapy in humans, a growing body of evidence indicates that zinc may preferentially kill prostate cancer cells. Because zinc naturally homes to the prostate and because the prostate is accessible with relatively non-invasive procedures, its potential as a chemotherapeutic agent in this type of cancer has shown promise.<ref>{{cite journal|last=Shah|first=Maulik|coauthors=Christopher Kriedt, Nathan H. Lents, Mary K. Hoyer, Nimah Jamaluddin, Claudette Kelin, Joseph J. Baldassare|title=Direct intra-tumoral injection of zinc-acetate halts tumor growth in a xenograft model of prostate cancer|journal=Journal of Experimental and Clinical Cancer Research|date=17|year=2009|month=June|volume=28|issue=84|doi=10.1186/1756-9966-28-84|pmid=19534805|url=http://www.jeccr.com/content/28/1/84|page=84|pmc=2701928}}</ref> However, other studies have demonstrated that chronic use of zinc supplements in excess of the recommended dosage may actually increase the chance of developing prostate cancer, also likely due to the natural buildup of this heavy metal in the prostate.<ref>{{cite journal|doi=10.1093/jnci/95.13.1004|url=http://jnci.oxfordjournals.org/content/95/13/1004.short|title=Zinc Supplement Use and Risk of Prostate Cancer|year=2003|last1=Leitzmann|first1=M. F.|last2=Stampfer|first2=M. J.|last3=Wu|first3=K.|last4=Colditz|first4=G. A.|last5=Willett|first5=W. C.|last6=Giovannucci|first6=E. L.|journal=JNCI Journal of the National Cancer Institute|volume=95|issue=13|page=1004}}</ref> |
|||
===Dùng làm thuốc ngoài da=== |
|||
{{further|Zinc oxide#Medical}} |
|||
[[Topical administration]] of zinc preparations include ones used on the skin, often in the form of [[zinc oxide]]. Zinc preparations can protect against [[sunburn]] in the summer and [[windburn]] in the winter.<ref name="Emsley2001p501"/> Applied thinly to a baby's diaper area ([[perineum]]) with each diaper change, it can protect against [[diaper rash]].<ref name="Emsley2001p501"/> |
|||
Zinc lactate is used in toothpaste to prevent [[halitosis]].<ref>{{Cite journal|volume =30|issue =5|page=427|year=2003|title=The effects of a new mouthrinse containing chlorhexidine, cetylpyridinium chloride and zinc lactate on the microflora of oral halitosis patients: a dual-centre, double-blind placebo-controlled study|author=Roldán, S.; Winkel, E. G.; Herrera, D.; Sanz, M.; Van Winkelhoff, A. J.|doi=10.1034/j.1600-051X.2003.20004.x|journal =Journal of Clinical Periodontology}}</ref> [[Zinc pyrithione]] is widely applied in shampoos because of its anti-dandruff function.<ref>{{cite journal|journal=British Journal of Dermatology|volume=112|issue=4|page=415|title=The effects of a shampoo containing zinc pyrithione on the control of dandruff|first=R.|last=Marks|coauthors=Pearse, A. D.; Walker, A. P.|doi=10.1111/j.1365-2133.1985.tb02314.x|year=1985}}</ref> |
|||
Zinc ions are effective [[antimicrobial agent]]s even at low concentrations.<ref>{{Cite journal|last=McCarthy|first=T J|coauthors=Zeelie, J J: Krause, D J|date=1992 Feb|title=The antimicrobial action of zinc ion/antioxidant combinations|journal=Clinical Pharmacology & Therapeutics|publisher=American Society for Clinical Pharmacology and Therapeutics|volume=17|issue=1|page=5}}</ref> |
|||
===Hóa hữu cơ=== |
|||
[[Image:DiphenylzincCarbonylAddition.png|thumb|350px|Addition of diphenylzinc to an aldehyde]] |
|||
There are many important [[organozinc compounds]]. Organozinc chemistry is the science of organozinc compounds describing their physical properties, synthesis and reactions.<ref>{{cite journal | doi = 10.1002/0471264180.or066.01 | chapter = The Allylic Trihaloacetimidate Rearrangement | title = Organic Reactions | year = 2005 | last1 = Overman | first1 = Larry E. | last2 = Carpenter | first2 = Nancy E. | isbn = 0-471-26418-0 }}</ref><ref>{{cite book | isbn = 0-470-09337-4| url = http://books.google.com/books?id=Y3wYEmIHlqUC | title = The Chemistry of Organozinc Compounds: R-Zn | author1 = Rappoport | first1 = Zvi | last2 = Marek | first2 = Ilan | date = 2007-12-17}}</ref><ref>{{cite book | isbn = 0-19-850121-8 | url = http://books.google.com/books?id=UH5tQgAACAAJ | title = Organozinc reagents: A practical approach | author1 = Knochel | first1 = Paul | last2 = Jones | first2 = Philip | year = 1999}}</ref><ref>{{cite book | url = http://books.google.com/books?id=hgUqZkG23PAC| isbn = 3-13-103061-5 | title = Synthetic Methods of Organometallic and Inorganic Chemistry: Catalysis | author1 = Herrmann | first1 = Wolfgang A | date = 2002-01}}</ref> |
|||
Among important applications is the Frankland-Duppa Reaction in which an [[oxalate]] [[ester]](ROCOCOOR) reacts with an [[alkyl halide]] R'X, zinc and [[hydrochloric acid]] to the α-hydroxycarboxylic esters RR'COHCOOR,<ref>{{cite web|url=http://www.drugfuture.com/OrganicNameReactions/ONR144.htm|title=Frankland-Duppa Reaction|accessdate=2012-02-13}}</ref> the [[Reformatskii reaction]] which converts α-halo-esters and aldehydes to β-hydroxy-esters, the [[Simmons–Smith reaction]] in which the carbenoid (iodomethyl)zinc iodide reacts with alkene(or alkyne) and converts them to cyclopropane, the [[Addition reaction]] of organozinc compounds to [[carbonyl]] compounds. The [[Barbier reaction]] (1899) which is the zinc equivalent of the magnesium [[Grignard reaction]] and is better of the two. In presence of just about any water the formation of the organomagnesium halide will fail whereas the Barbier reaction can even take place in water. On the downside organozincs are much less nucleophilic than Grignards, are expensive and difficult to handle. Commercially available diorganozinc compounds are [[dimethylzinc]], [[diethylzinc]] and diphenylzinc. In one study<ref>{{cite journal | doi = 10.1002/anie.200600741 | title = From Aryl Bromides to Enantioenriched Benzylic Alcohols in a Single Flask: Catalytic Asymmetric Arylation of Aldehydes | year = 2006 | last1 = Kim | first1 = Jeung Gon | last2 = Walsh | first2 = Patrick J. | journal = Angewandte Chemie International Edition | volume = 45 | issue = 25 | pages = 4175}}</ref><ref>In this [[one-pot reaction]] [[bromobenzene]] is converted to [[phenyllithium]] by reaction with 4 equivalents of [[N-Butyllithium|''n''-butyllithium]], then transmetalation with [[zinc chloride]] forms diphenylzinc which continues to react in an [[asymmetric reaction]] first with the [[MIB ligand]] and then with 2-naphthylaldehyde to the [[alcohol]]. In this reaction formation of diphenylzinc is accompanied by that of [[lithium chloride]], which unchecked, catalyses the reaction without MIB involvement to the [[racemic]] [[alcohol]]. The salt is effectively removed by [[chelation]] with [[tetraethylethylene diamine]] (TEEDA) resulting in an [[enantiomeric excess]] of 92%.</ref> the active organozinc compound is obtained from much cheaper [[organobromine compound|organobromine]] precursors: |
|||
The [[Negishi coupling]] is also an important reaction for the formation of new carbon carbon bonds between unsaturated carbon atoms in alkenes, arenes and alkynes. The catalysts are nickel and palladium. A key step in the [[catalytic cycle]] is a [[transmetalation]] in which a zinc halide exchanges its organic substituent for another halogen with the palladium (nickel) metal center. The [[Fukuyama coupling]] is another coupling reaction but this one with a thioester as reactant forming a ketone. |
|||
<!-- NEEDS CITE |
|||
Organozinc compounds usually contain zinc in +2 oxidation state, but compounds in +1 state are also known such as [[decamethyldizincocene]]. --> |
|||
=== Hợp chất === |
=== Hợp chất === |
||
Phiên bản lúc 14:37, ngày 4 tháng 4 năm 2013
| Kẽm, 30Zn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Các mảnh và khối kẽm với độ tinh khiết 99,995% | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Quang phổ vạch của kẽm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên, ký hiệu | Kẽm, Zn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Ánh kim bạc xám | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kẽm trong bảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử (Z) | 30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn (±) (Ar) | 65,38(2)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | kim loại chuyển tiếp | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm, phân lớp | 12, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | [Ar] 3d10 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 8, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Ánh kim bạc xám | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất rắn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | 692,68 K (419,53 °C, 787,15 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | 1.180 K (907 °C, 1.665 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | 7,14 g·cm−3 (ở 0 °C, 101.325 kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ ở thể lỏng | ở nhiệt độ nóng chảy: 6,57 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | 7,32 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | 123,6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | 25,470 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | 2, 1, 0, -2 Lưỡng tính | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 1,65 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 906,4 kJ·mol−1 Thứ hai: 1.733,3 kJ·mol−1 Thứ ba: 3.833 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính cộng hoá trị | thực nghiệm: 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 122±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lục phương | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vận tốc âm thanh | que mỏng: (Cuộn dây) 3850 m·s−1 (ở r.t.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ giãn nở nhiệt | 30,2 µm·m−1·K−1 (ở 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 116 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điện trở suất | ở 20 °C: 59,0 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Nghịch từ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun Young | 108 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun cắt | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun khối | 70 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hệ số Poisson | 0,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Mohs | 2,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Brinell | 412 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7440-66-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính: Đồng vị của Kẽm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kẽm là một nguyên tố kim loại lưỡng tính, kí hiệu là Zn và có số nguyên tử là 30. Nó là nguyên tố đầu tiên trong nhóm 12 của bảng tuần hoàn nguyên tố. Kẽm, trên một số phương diện, có tính chất hóa học giống với magiê, vì ion của chúng có bán kính giống nhau và có trạng thái oxi hóa duy nhất ở điều kiện bình thường là +2. Kẽm là nguyên tố phổ biến thứ 24 trong lớp vỏ Trái Đất và có 5 đồng vị bền. Quặng kẽm phổ biến nhất là quặng sphalerit, một loại sulfua kẽm. Những mỏ khai thác lớn nhất nằm ở Úc, Canada và Hoa Kỳ. Công nghệ sản xuất kẽm bao gồm tuyển nổi quặng, thiêu kết, và cuối cùng là chiết tách bằng dòng điện.
Đồng thau là một hợp kim của đồng và kẽm đã bắt đầu được sử dụng muộn nhất từ thế kỷ 10 TCN. Mãi cho đến thế kỷ 13 thì kẽm nguyên chất mới được sản xuất quy mô lớn ở Ấn Độ, và đến cuối thế kỷ 16 thì người châu Âu mới biết đến kẽm kim loại. Các nhà giả kim thuật đốt kẽm trong không khí để tạo thành một chất mà họ gọi là "len của nhà triết học" hay "tuyết trắng". Nhà hóa học người Đức Andreas Sigismund Marggraf được công nhận đã tách được kẽm kim loại tinh khiết năm 1746. Luigi Galvani và Alessandro Volta đã phát hiện ra các đặc tính hóa điện của kẽm năm vào 1800. Ứng dụng chính của kẽm là làm lớp phủ chống ăn mòn trên thép. Các ứng dụng khác như làm pin kẽm, và hợp kim như đồng thau. Nhiều hợp chất kẽm cũng được sử dụng phổ biến như kẽm cacbonat và kẽm gluconat (bổ sung dinh dưỡng), kẽm clorua (chất khử mùi), kẽm pyrithion (dầu gội đầu trị gàu), kẽm sulfua (sơn huỳnh quang), và kẽm methyl hay kẽm diethyl sử dụng trong hóa hữu cơ ở phòng thí nghiệm.
Kẽm là một chất khoáng vi lượng thiết yếu cho sinh vật và sức khỏe con người.[4] Thiếu kẽm ảnh hưởng đến khoảng 2 tỷ người ở các nước đang phát triển và liên quan đến nguyên nhân một số bệnh.[5] Ở trẻ em, thiếu kẽm gây ra chứng chậm phát triển, phát dục trễ, dễ nhiễm trùng và tiêu chảy, các yếu tố này gây thiệt mạng khoảng 800.000 trẻ em trên toàn thế giới mỗi năm.[4] Các enzym liên kết với kẽm trong trung tâm phản ứng có vai trò sinh hóa quan trọng như alcohol dehydrogenase ở người. Ngược lại việc tiêu thụ quá mức kẽm có thể gây ra một số chứng như hôn mê, bất động cơ và thiếu đồng.
Tính chất
Kẽm là một kim loại hoạt động trung bình có thể kết hợp với ôxy và các á kim khác, có phản ứng với axít loãng để giải phóng hiđrô. Trạng thái ôxi hóa phổ biến của kẽm là +2.
Vật lý
Kẽm có màu trắng xanh, óng ánh và nghịch từ,[6] mặc dù hầu hết kẽm phẩm cấp thương mại có màu xám xỉn.[7] Nó hơi nhẹ hơn sắt và có cấu trúc tinh thể sáu phương.[8]
Kẽm kim loại cứng và giòn ở hầu hết cấp nhiệt độ nhưng trở nên dễ uốn từ 100 đến 150 °C.[6][7] Trên 210 °C, kim loại kẽm giòn trở lại và có thể được tán nhỏ bằng lực.[9] Kẽm dẫn điện khá.[6] So với các kim loại khác, kẽm có độ nóng chảy (419,5 °C, 787,1F) và điểm sôi (907 °C) tương đối thấp.[10] Điểm sôi của nó là một trong số những điểm sôi thấp nhất của các kim loại chuyển tiếp, chỉ cao hơn thủy ngân và cadmi.[10]
Một số hợp kim với kẽm như đồng thau, là hợp kim của kẽm và đồng. Các kim loại khác có thể tạo hợp kim 2 phần với kẽm như nhôm, antimon, bitmut, vàng, sắt, chì, thủy ngân, bạc, thiếc, magiê, coban, niken, telua và natri.[11] Tuy cả kẽm và zirconi không có tính sắt từ, nhưng hợp kim của chúng ZrZn
2 lại thể hiện tính chất sắt từ dưới 35 K.[6]
Phân bố
Kẽm chiếm khoảng 75 ppm (0,0075%) trong vỏ Trái Đất, là nguyên tố phổ biến thứ 24. Đất chứa 5–770 ppm kẽm với giá trị trung bình 64 ppm. Nước biển chỉ chứa 30 ppb kẽm và trong khí quyển chứa 0,1–4 µg/m3.[12]

Nguyên tố này thường đi cùng với các nguyên tố kim loại thông thường khác như đồng và chì ở dạng quặng.[13] Kẽm là một nguyên tố ưa tạo quặng (chalcophile), nghĩa là nguyên tố có ái lực thấp với ôxy và thường liên kết với lưu huỳnh để tạo ra các sulfua. Các nguyên tố ưa tạo quặng hình thành ở dạng lớp vỏ hóa cứng trong các điều kiện khử của khí quyển Trái Đất.[14] Sphalerit là một dạng kẽm sulfua, và là loại quặng chứa nhiều kẽm nhất với hàm lượng kẽm lên đến 60–62%.[13]
Các loại quặng khác có thể thu hồi được kẽm như smithsonit (kẽm cacbonat), hemimorphit (kẽm silicat), wurtzit (loại kẽm sulfua khác), và đôi khi là hydrozincit (kẽm cacbonat).[15] Ngoại trừ wurtzit, tất cả các khoáng trên được hình thành từ các quá trình phong hóa kẽm sulfua nguyên sinh.[14]
Tổng tài nguyên kẽm trên thế giới đã được xác nhận vào khoảng 1,9 tỉ tấn.[16] Các mỏ kẽm lớn phân bố ở Úc và Mỹ, và trữ lượng kẽm lớn nhất ở Iran.[14][17][18] Với tốc độ tiêu thụ như hiện nay thì nguồn tài nguyên này ước tính sẽ cạn kiệt vào khoảng năm từ 2027 đến 2055.[19][20] Khoảng 346 triệu tấn kẽm đã được sản xuất trong suốt chiều dài lịch sử cho đến năm 2002, và theo một ước lượng cho thấy khoảng 109 triệu tấn tồn tại ở các dạng đang sử dụng.[21]
Đồng vị
Kẽm trong tự nhiên là hỗn hợp của 5 đồng vị ổn định 64Zn, 66Zn, 67Zn, 68Zn và 70Zn, trong đó đồng vị 64 là phổ biến nhất (48,6% trong tự nhiên)[22] với chu kỳ bán rã 43×1018 năm,[23] do đó tính phóng xạ của nó có thể bỏ qua.[24] Tương tự, 70
30Zn
(0,6%), có chu kỳ bán rã 13×1016 năm thường không được xem là có tính phóng xạ. Các đồng vị khác là 66
Zn (28%), 67
Zn (4%) và 68
Zn (19%).
Một số đồng vị phóng xạ đã được nhận dạng. 65
Zn có chu kỳ bán rã 243,66 ngày, là đồng vị tồn tại lâu nhất, theo sau là 72
Zn có chu kỳ bán rã 46,5 giờ.[22] Kẽm có 10 đồng phân hạt nhân. 69mZn có chu kỳ bán rã 13,76 giờ.[22] (tham số mũ m chỉ đồng vị giả ổn định). Các hạt nhân của đồng vị giả ổn định ở trong trạng thái kích thích và sẽ trở về trạng thái bình thường khi phát ra photon ở dạng tia gamma. 61
Zn có 3 trạng thái kích thích và 73
Zn có 2 trạng thái.[25] Mỗi đồng vị 65
Zn, 71
Zn, 77
Zn và 78
Zn chỉ có một trạng thái kích thích.[22]
Cơ chế phân rã phổ biến của đồng vị phóng xạ kẽm có số khối nhỏ hơn 66 là bắt electron, sản phẩm tạo thành là một đồng vị của đồng.[22]
- n
30Zn
+ e⁻
→ n
29Cu
Cơ chế phân rã phổ biến của đồng vị phóng xạ kẽm có số khối lớn hơn 66 là phân rã beta (β–), sản phẩm tạo ra là đồng vị của gali.[22]
Hợp chất và tính chất hóa học
Khả năng phản ứng
Kẽm có cấu hình electron là [Ar]3d104s2 và là nguyên tố thuộc nhóm 12 trong bảng tuần hoàn. Nó là kim loại có độ hoạt động trung bình và là chất ôxi hóa mạnh.[26] Bề mặt của kim loại kẽm tinh khiết xỉn nhanh, thậm chí hình thành một lớp thụ động bảo vệ là kẽm cacbonat, Zn
5(OH)
6(CO3)
2, khi phản ứng với cacbon điôxít trong khí quyển.[27] Lớp này giúp chống lại quá trình phản ứng tiếp theo với nước và không khí.
Kẽm cháy trong không khí cho ngọn lửa màu xanh lục tạo ra khói kẽm ôxít.[28] Kẽm dễ dàng phản ứng với các axít, kiềm và các phi kim khác.[29] Kẽm cực kỳ tinh khiết chỉ phản ứng một cách chậm chạp với các axít ở nhiệt độ phòng.[28] Các axít mạnh như axít clohydric hay axít sulfuric có thể hòa tan lớp vảo vệ bên ngoài và sau đó kẽm phản ứng với nước giải phóng khí hydro.[28]
Tính chất hóa học của kẽm đặc trưng bởi trạng thái ôxi hóa +2. Khi các hợp chất ở trạng thái này được hình thành thì các electron lớp s bị mất đi, và ion kẽm có cấu hình electron [Ar]3d10.[30] Quá trình này cho phép tạo 4 liên kết bằng cách tiếp nhận thêm 4 cặp electron theo quy tắc bộ tám. Dạng cấu tạo hóa học lập thể là tứ diện và các liên kết có thể được miêu tả như sự tạo thành của các orbitan lai ghép sp3 của ion kẽm.[31] Trong dung dịch, nó tạo phức phổ biến dạng bát diện là [Zn(H
2O)6]2+
.[32] Sự bay hơi của kẽm khi kết hợp với kẽm clorua ở nhiệt độ trên 285 °C chỉ ra sự hình thành Zn
2Cl
2, một hợp chất kẽm có trạng thái ôxi hóa +1.[28] Không có hợp chất kẽm nào mà kẽm có trạng thái ôxi hóa khác +1 hoặc +2.[33] Các tính toán chỉ ra rằng hợp chất kẽm có trạng thái ôxi hóa +4 không thể tồn tại.[34]
Tính chất hóa học của kẽm tương tự tính chất của các kim loại chuyển tiếp nằm ở vị trí cuối cùng của hàng đầu tiên như niken và đồng, mặc dù nó có lớp d được lấp đầy electron, do đó các hợp chất của nó là nghịch từ và hầu như không màu.[35] Bán kính ion của kẽm và magiê gần như bằng nhau. Do đó một số muối của chúng có cùng cấu trúc tinh thể[36] và trong một số trường hợp khi bán kính ion là yếu tố quyết định thì tính chất hóa học của kẽm và magiê là rất giống nhau.[28] còn nếu không thì chúng có rất ít nét tương đồng. Kẽm có khuynh hướng tạo thành các liên kết cộng hóa trị với cấp độ cao hơn và nó tạo thành các phức bền hơn với các chất cho N- và S.[35] Các phức của kẽm hầu hết là có phối vị 4 hoặc 6, tuy nhiên phức phối vị 5 cũng có.[28]
Hợp chất


Hợp chất hai nguyên tố của kẽm được tạo ra với hầu hết á kim và tất cả các phi kim trừ khí hiếm. ZnO là chất bột màu trắng và hầu như không tan trong các dung dịch trung tính, vì là một chất trung tính nó tan trong cả dung dịch axit và bazơ.[28] Các chalcogenua khác (ZnS, ZnSe, và ZnTe) có nhiều ứng dụng khác nhau trong điện tử và quang học.[37] Pnictogenua (Zn
3N
2, Zn
3P
2, Zn
3As
2 và Zn
3Sb
2),[38][39] peroxit (ZnO
2), hydrua (ZnH
2), và cacbua (ZnC
2) cũng tồn tại.[40] Trong số 4 halua, ZnF
2 có đặc trưng ion nhiều nhất, trong khi các hợp chất halua khác (ZnCl
2, ZnBr
2, và ZnI
2) có điểm nóng chảy tương đối thấp và được xem là có nhiều đặc trưng cộng hóa trị hơn.[41]
Trong các dung dịch bazơ yếu chứa các ion Zn2+
, hydroxit Zn(OH)
2 tạo thành ở dạng kết tủa màu trắng. Trong các dung dịch kiềm mạnh hơn, hydroxit này bị hòa tan và tạo zincat ([Zn(OH)4]2−
).[28] Nitrat Zn(NO3)
2, clorat Zn(ClO3)
2, sulfat ZnSO
4, photphat Zn
3(PO4)
2, molybdat ZnMoO
4, cyanua Zn(CN)
2, asenit Zn(AsO2)
2, asenat Zn(AsO4)
2·8H
2O và cromat ZnCrO
4 (một trong những hợp chất kẽm có màu) là một vài ví dụ về các hợp chất vô cơ phổ biến của kẽm.[42][43] Một trong những ví dụ đơn giản nhất về hợp chất hữu cơ của kẽm là acetat (Zn(O
2CCH3)
2).
Các hợp chất hữu cơ của kẽm là dạng hợp chất mà trong đó có các liên kết cộng hóa trị kẽm-cacbon. Diethyl kẽm ((C
2H5)
2Zn) là một thuốc thử trong hóa tổng hợp. Nó được công bố đầu tiên năm 1848 từ phản ứng của kẽm và ethyl iodua, và là hợp chất đầu tiên chứa liên kết sigma kim loại-cacbon.[44] Decamethyldizincocen chứa một liên kết mạnh kẽm-kẽm ở nhiệt độ phòng.[45]
Ứng dụng



Kẽm là kim loại được sử dụng phổ biến hàng thứ tư sau sắt, nhôm, đồng tính theo lượng sản xuất hàng năm.
Chống ăn mòn và pin
Kim loại kẽm chủ yếu được dùng làm chất chống ăn mòn,[46] ở dạng mạ. Năm 2009 ở Hoa Kỳ, 55% tương đương 893 tấn kẽm kim loại được dùng để mạ.[47]
Kẽm phản ứng mạnh hơn sắt hoặc thép và do đó nó sẽ dễ bị ô xy hóa cho đến khi nó bị ăn mòn hoàn toàn.[48] Một lớp tráng bề mặt ở dạng bằng ôxít và carbonat (Zn
5(OH)
6(CO
3)
2) là một chất ăn mòn từ kẽm.[49] Lớp bảo vệ này tồn tại kéo dài ngay cả sau khi lớp kẽm bị trầy xướt, nhưng nó sẽ giảm theo thời gian khi lớp ăn mòn kẽm bị tróc đi.[49] Kẽm được phủ lên theo phương pháp hóa điện bằng cách phun hoặc mạ nhúng nóng.[12] Mạ được sử dụng trên rào kẽm gai, rào bảo vệ, cầu treo, mái kim loại, thiết bị trao đổi nhiệt, và bộ phận của ô tô.[12]
Độ hoạt động tương đối của kẽm và khả năng của nó bị ôxy hóa làm nó có hiệu quả trong việc hi sinh anot để bảo vệ ăn mòn catot. Ví dụ, bảo vệ catot của một đường ống được chôn dưới đất có thể đạt hiệu quả bằng cách kết nối các anot được làm bằng kẽm với các ống này.[49] Kẽm có vai trò như một anot (âm) bằng các ăn mòn một cách chậm chạp khi dòng điện chạy qua nó đến ống dẫn bằng thép.[49][note 1] Kẽm cũng được sử dụng trong việt bảo vệ các kim loại được dùng làm catot khi chúng bị ăn mòn khi tiếp xúc với nước biển.[50] Một đĩa kẽm được gắn với một bánh lái bằng sắt của tàu sẽ làm chậm tốc độ ăn mòn so với không gắn tấm kẽm này.[48] Các ứng dụng tương tự như gắn kẽm vào chân vịt hoặc lớp kim loại bảo vệ lườn tàu.
Với một thế điện cực chuẩn (SEP) 0,76 vôn, kẽm được sử dụng làm vật liệu anot cho pin. Bột kẽm được sử dụng theo cách này trong các loại pin kiềm và các tấm kẽm kim loại tạo thành vỏ bọc và cũng là anot trong pin kẽm-carbon.[51][52] Kẽm được sử dụng làm anot hoặc nhiên liệu cho tế bào nhiêu liệu kẽm/pin kẽm-không khí.[53][54][55]
Bài viết này là công việc biên dịch đang được tiến hành từ bài viết [[:FromLanguage:|]] từ một ngôn ngữ khác sang tiếng Việt. Bạn có thể giúp Wikipedia bằng cách hỗ trợ dịch và trau chuốt lối hành văn tiếng Việt theo cẩm nang của Wikipedia. |
Hợp kim
A widely used alloy which contains zinc is brass, in which copper is alloyed with anywhere from 3% to 45% zinc, depending upon the type of brass.[49] Brass is generally more ductile and stronger than copper and has superior corrosion resistance.[49] These properties make it useful in communication equipment, hardware, musical instruments, and water valves.[49]

Other widely used alloys that contain zinc include nickel silver, typewriter metal, soft and aluminium solder, and commercial bronze.[6] Zinc is also used in contemporary pipe organs as a substitute for the traditional lead/tin alloy in pipes.[56] Alloys of 85–88% zinc, 4–10% copper, and 2–8% aluminium find limited use in certain types of machine bearings. Zinc is the primary metal used in making American one cent coins since 1982.[57] The zinc core is coated with a thin layer of copper to give the impression of a copper coin. In 1994, 33.200 tấn (36.600 tấn Mỹ) of zinc were used to produce 13.6 billion pennies in the United States.[58]
Alloys of primarily zinc with small amounts of copper, aluminium, and magnesium are useful in die casting as well as spin casting, especially in the automotive, electrical, and hardware industries.[6] These alloys are marketed under the name Zamak.[59] An example of this is zinc aluminium. The low melting point together with the low viscosity of the alloy makes the production of small and intricate shapes possible. The low working temperature leads to rapid cooling of the cast products and therefore fast assembly is possible.[6][60] Another alloy, marketed under the brand name Prestal, contains 78% zinc and 22% aluminium and is reported to be nearly as strong as steel but as malleable as plastic.[6][61] This superplasticity of the alloy allows it to be molded using die casts made of ceramics and cement.[6]
Similar alloys with the addition of a small amount of lead can be cold-rolled into sheets. An alloy of 96% zinc and 4% aluminium is used to make stamping dies for low production run applications for which ferrous metal dies would be too expensive.[62] In building facades, roofs or other applications in which zinc is used as sheet metal and for methods such as deep drawing, roll forming or bending, zinc alloys with titanium and copper are used.[63] Unalloyed zinc is too brittle for these kinds of manufacturing processes.[63]
As a dense, inexpensive, easily worked material, zinc is used as a lead replacement. In the wake of lead concerns, zinc appears in weights for various applications ranging from fishing[64] to tire balances and flywheels.[65]
Cadmium zinc telluride (CZT) is a semiconductive alloy that can be divided into an array of small sensing devices.[66] These devices are similar to an integrated circuit and can detect the energy of incoming gamma ray photons.[66] When placed behind an absorbing mask, the CZT sensor array can also be used to determine the direction of the rays.[66]
Các ứng dụng công nghiệp khác

Roughly one quarter of all zinc output in the United States (2009), is consumed in the form of zinc compounds;[47] a variety of which are used industrially. Zinc oxide is widely used as a white pigment in paints, and as a catalyst in the manufacture of rubber. It is also used as a heat disperser for the rubber and acts to protect its polymers from ultraviolet radiation (the same UV protection is conferred to plastics containing zinc oxide).[12] The semiconductor properties of zinc oxide make it useful in varistors and photocopying products.[67] The zinc zinc-oxide cycle is a two step thermochemical process based on zinc and zinc oxide for hydrogen production.[68]
Zinc chloride is often added to lumber as a fire retardant[69] and can be used as a wood preservative.[70] It is also used to make other chemicals.[69] Zinc methyl (Zn(CH3)
2) is used in a number of organic syntheses.[71] Zinc sulfide (ZnS) is used in luminescent pigments such as on the hands of clocks, X-ray and television screens, and luminous paints.[72] Crystals of ZnS are used in lasers that operate in the mid-infrared part of the spectrum.[73] Zinc sulfate is a chemical in dyes and pigments.[69] Zinc pyrithione is used in antifouling paints.[74]
Zinc powder is sometimes used as a propellant in model rockets.[75] When a compressed mixture of 70% zinc and 30% sulfur powder is ignited there is a violent chemical reaction.[75] This produces zinc sulfide, together with large amounts of hot gas, heat, and light.[75] Zinc sheet metal is used to make zinc bars.[76]
64
Zn, the most abundant isotope of zinc, is very susceptible to neutron activation, being transmuted into the highly radioactive 65
Zn, which has a half-life of 244 days and produces intense gamma radiation. Because of this, Zinc Oxide used in nuclear reactors as an anti-corrosion agent is depleted of 64
Zn before use, this is called depleted zinc oxide. For the same reason, zinc has been proposed as a salting material for nuclear weapons (cobalt is another, better-known salting material).[77] A jacket of isotopically enriched 64
Zn would be irradiated by the intense high-energy neutron flux from an exploding thermonuclear weapon, forming a large amount of 65
Zn significantly increasing the radioactivity of the weapon's fallout.[77] Such a weapon is not known to have ever been built, tested, or used.[77] 65
Zn is also used as a tracer to study how alloys that contain zinc wear out, or the path and the role of zinc in organisms.[78]
Zinc dithiocarbamate complexes are used as agricultural fungicides; these include Zineb, Metiram, Propineb and Ziram.[79] Zinc naphthenate is used as wood preservative.[80] Zinc, in the form of ZDDP, is also used as an anti-wear additive for metal parts in engine oil.[81]
Bổ sung trong khẩu phần ăn

Zinc is included in most single tablet over-the-counter daily vitamin and mineral supplements.[82] Preparations include zinc oxide, zinc acetate, and zinc gluconate.[82] It is believed to possess antioxidant properties, which may protect against accelerated aging of the skin and muscles of the body; studies differ as to its effectiveness.[83] Zinc also helps speed up the healing process after an injury.[83] It is also beneficial to the body's immune system. Indeed, zinc deficiency may have effects on virtually all parts of the human immune system.[84] The efficacy of zinc compounds when used to reduce the duration or severity of cold symptoms is controversial.[85] A 2011 systematic review concludes that supplementation yields a mild decrease in duration and severity of cold symptoms.[86]
Zinc serves as a simple, inexpensive, and critical tool for treating diarrheal episodes among children in the developing world. Zinc becomes depleted in the body during diarrhea, but recent studies suggest that replenishing zinc with a 10- to 14-day course of treatment can reduce the duration and severity of diarrheal episodes and may also prevent future episodes for up to three months.[87]

The Age-Related Eye Disease Study determined that zinc can be part of an effective treatment for age-related macular degeneration.[88] Zinc supplementation is an effective treatment for acrodermatitis enteropathica, a genetic disorder affecting zinc absorption that was previously fatal to babies born with it.[89]
Gastroenteritis is strongly attenuated by ingestion of zinc, and this effect could be due to direct antimicrobial action of the zinc ions in the gastrointestinal tract, or to the absorption of the zinc and re-release from immune cells (all granulocytes secrete zinc), or both.[90][91][note 2] In 2011, researchers at John Jay College of Criminal Justice reported that dietary zinc supplements can mask the presence of drugs in urine. Similar claims have been made in web forums on that topic.[92]
Although not yet tested as a therapy in humans, a growing body of evidence indicates that zinc may preferentially kill prostate cancer cells. Because zinc naturally homes to the prostate and because the prostate is accessible with relatively non-invasive procedures, its potential as a chemotherapeutic agent in this type of cancer has shown promise.[93] However, other studies have demonstrated that chronic use of zinc supplements in excess of the recommended dosage may actually increase the chance of developing prostate cancer, also likely due to the natural buildup of this heavy metal in the prostate.[94]
Dùng làm thuốc ngoài da
Topical administration of zinc preparations include ones used on the skin, often in the form of zinc oxide. Zinc preparations can protect against sunburn in the summer and windburn in the winter.[89] Applied thinly to a baby's diaper area (perineum) with each diaper change, it can protect against diaper rash.[89]
Zinc lactate is used in toothpaste to prevent halitosis.[95] Zinc pyrithione is widely applied in shampoos because of its anti-dandruff function.[96] Zinc ions are effective antimicrobial agents even at low concentrations.[97]
Hóa hữu cơ

There are many important organozinc compounds. Organozinc chemistry is the science of organozinc compounds describing their physical properties, synthesis and reactions.[98][99][100][101] Among important applications is the Frankland-Duppa Reaction in which an oxalate ester(ROCOCOOR) reacts with an alkyl halide R'X, zinc and hydrochloric acid to the α-hydroxycarboxylic esters RR'COHCOOR,[102] the Reformatskii reaction which converts α-halo-esters and aldehydes to β-hydroxy-esters, the Simmons–Smith reaction in which the carbenoid (iodomethyl)zinc iodide reacts with alkene(or alkyne) and converts them to cyclopropane, the Addition reaction of organozinc compounds to carbonyl compounds. The Barbier reaction (1899) which is the zinc equivalent of the magnesium Grignard reaction and is better of the two. In presence of just about any water the formation of the organomagnesium halide will fail whereas the Barbier reaction can even take place in water. On the downside organozincs are much less nucleophilic than Grignards, are expensive and difficult to handle. Commercially available diorganozinc compounds are dimethylzinc, diethylzinc and diphenylzinc. In one study[103][104] the active organozinc compound is obtained from much cheaper organobromine precursors:
The Negishi coupling is also an important reaction for the formation of new carbon carbon bonds between unsaturated carbon atoms in alkenes, arenes and alkynes. The catalysts are nickel and palladium. A key step in the catalytic cycle is a transmetalation in which a zinc halide exchanges its organic substituent for another halogen with the palladium (nickel) metal center. The Fukuyama coupling is another coupling reaction but this one with a thioester as reactant forming a ketone.
Hợp chất
Ô xít kẽm có lẽ là hợp chất được sử dụng rộng rãi nhất của kẽm, do nó tạo ra nền trắng tốt cho chất liệu màu trắng trong sản xuất sơn. Nó cũng có ứng dụng trong công nghiệp cao su, và nó được mua bán như là chất chống nắng mờ. Các loại hợp chất khác cũng có ứng dụng trong công nghiệp, chẳng hạn như clorua kẽm (chất khử mùi), sulfua kẽm (lân quang), methyl kẽm trong các phòng thí nghiệm về chất hữu cơ. Khoảng một phần tư sản lượng kẽm sản xuất hàng năm được tiêu thụ dưới dạng các hợp chất của nó.
- Ôxít kẽm được sử dụng như chất liệu có màu trắng trong màu nước và sơn cũng như chất hoạt hóa trong công nghiệp ô tô. Sử dụng trong thuốc mỡ, nó có khả năng chống cháy nắng cho các khu vực da trần. Sử dụng như lớp bột mỏng trong các khu vực ẩm ướt của cơ thể (bộ phận sinh dục) của trẻ em để chống hăm.
- Clorua kẽm được sử dụng làm chất khử mùi và bảo quản gỗ.
- Sulfua kẽm được sử dụng làm chất lân quang, được sử dụng để phủ lên kim đồng hồ hay các đồ vật khác cần phát sáng trong bóng tối.
- Methyl kẽm (Zn(CH3)2) được sử dụng trong một số phản ứng tổng hợp chất hữu cơ.
- Stearat kẽm được sử dụng làm chất độn trong sản xuất chất dẻo (plastic) từ dầu mỏ.
- Các loại nước thơm sản xuất từ calamin, là hỗn hợp của(hydroxy-)cacbonat kẽm và silicat, được sử dụng để chống phỏng da.
- Trong thực đơn hàng ngày, kẽm có trong thành phần của các loại khoáng chất và vitamin. Người ta cho rằng kẽm có thuộc tính chống ôxi hóa, do vậy nó được sử dụng như là nguyên tố vi lượng để chống sự chết yểu của da và cơ trong cơ thể (lão hóa). Trong các biệt dược chứa một lượng lớn kẽm, người ta cho rằng nó có tác dụng nhanh làm lành vết thương.
- Gluconat glycin kẽm trong các viên nang hình thoi có tác dụng chống cảm.
Lịch sử
Thời kỳ cổ đại
Các mẫu vật riêng biệt sử dụng kẽm không nguyên chất trong thời kỳ cổ đại đã được phát hiện. Một bức tượng nhỏ có thể từ thời tiền sử chứa 87,5% kẽm được tìm thấy ở di chỉ khảo cổ Dacia ở Transylvania (Romania ngày nay).[105] Các đồ trang trí bằng hợp kim chứa 80–90% kẽm với chì, sắt, antimon và các kim loại khác cấu thành phần còn lại, đã được phát hiện có độ tuổi là 2.500 năm.[13] Bảng kẽm Bern là một tấm thẻ tạ ơn có niên đại tới thời kỳ Gaul La Mã được làm bằng hợp kim bao gồm phần lớn là kẽm.[106] Một số văn bản cổ đại dường như cũng đề cập đến kẽm. Sử gia Hy Lạp Strabo, trong một đoạn văn lấy từ nhà văn trước đó trong thế kỷ 4 TCN, đề cập tới "những giọt bạc giả", được trộn lẫn với đồng để làm đồng thau. Điều này có thể đề cập đến một lượng nhỏ kẽm là phụ phẩm của quá trình nung chảy quặng sulfua.[107] Charaka Samhita, cho là đã được viết vào 500 TCN hay trước đó nữa, đề cập đến một kim loại mà khi bị ôxi hóa, tạo ra pushpanjan, sản phẩm được cho là kẽm ôxít.[108]
Các loại quặng kẽm đã được sử dụng để làm hợp kim đồng-kẽm là đồng thau vài thế kỷ trước khi phát hiện ra kẽm ở dạng nguyên tố riêng biệt. Đồng thau Palestin có từ thế kỷ 14 TCN đến thế kỷ 10 TCN chứa 23% kẽm.[109]
Việc sản xuất đồ đồng thau đã được người La Mã biết đến vào khoảng năm 30 TCN,[89] họ sử dụng công nghệ nấu calamin (kẽm silicat hay cacbonat) với than củi và đồng trong các nồi nấu.[89] Lượng ôxít kẽm giảm xuống và kẽm tự do bị đồng giữ lại, tạo ra hợp kim là đồng thau. Đồng thau sau đó được đúc hay rèn thành các chủng loại đồ vật và vũ khí.[110] Một số tiền xu từ người La Mã trong thời đại Công giáo được làm từ loại vật liệu có thể là đồng thau calamin.[111] Ở phương Tây, kẽm lẫn tạp chất từ thời cổ đại tồn tại ở dạng tàn dư trong lò nung chảy, nhưng nó thường bị bỏ đi vì người ta nghĩ nó không có giá trị.[112]
Các mỏ kẽm ở Zawar, gần Udaipur, Ấn Độ đã từng hoạt động từ thời đại Maurya vào cuối thiên niên kỷ 1 TCN. Việc nấu chảy và phân lập kẽm nguyên chất đã được những người Ấn Độ thực hiện sớm nhất vào thế kỷ 12.[113][114] Một ước tính cho thấy rằng khu vực này đã sản xuất ra khoảng vài triệu tấn kẽm kim loại và kẽm ôxít từ thế kỷ 12 đến thế kỷ 16.[15] Một ước tính khác đưa ra con số sản lượng là 60.000 tấn kẽm kim loại trong giai đoạn này.[113] Rasaratna Samuccaya, được viết vào khoảng thế kỷ 14, đề cập đến 2 loại quặng chứa kẽm; một loại được sử dụng để tách kim loại và loại khác được dùng cho y học.[114]
Các nghiên cứu trước đây và tên gọi
Kẽm đã từng được công nhận là một kim loại có tên gọi ban đầu là Fasada theo như y học Lexicon được cho là của vua Hindu Madanapala và được viết vào khoảng năm 1374.[115] Nung chảy và tách kẽm nguyên chất bằng cách khử calamin với len và các chất hữu cơ khác đã được tiến hành vào thế kỷ 13 ở Ấn Độ.[6][116] Người Trung Quốc cho tới thế kỷ 17 vẫn chưa học được kỹ thuật này.[116]
Các nhà giả kim thuật đã đốt kẽm kim loại trong không khí và thu được kẽm ôxít trong một lò ngưng tụ. Một số nhà giả kim thuật gọi loại kẽm ôxít này là lana philosophica, tiếng Latin có nghĩa là "len của các nhà triết học", do nó được thu hồi từ búi len trong khi những người khác nghĩ nó giống như tuyết trắng và đặt tên nó là nix album.[117]
Tên gọi của kẽm ở phương Tây có thể được ghi nhận đầu tiên bởi nhà giả kim Đức gốc Thụy Sĩ Paracelsus, ông đã gọi tên kim loại này là "zincum" hay "zinken" trong quyển sách của mình là Liber Mineralium II được viết vào thế kỷ 16.[116][118] Từ này có thể bắt nguồn từ tiếng Đức [zinke] lỗi: {{lang}}: văn bản có thẻ đánh dấu in xiên (trợ giúp), và có thể có nghĩa là "giống như răng, nhọn hoặc lởm chởm" (các tinh thể kẽm kim loại có hình dạng giống như những chiếc kim).[119] Zink cũng có thể ám chỉ "giống như tin (thiếc)" do mối quan hệ của nó (trong tiếng Đức zinn nghĩa là thiếc).[120] Một khả năng khác có thể là từ đó xuất phát từ tiếng Ba Tư سنگ seng nghĩa là đá.[121] Kim loại cũng có thể gọi là thiếc Ấn Độ, tutanego, calamin, và spinter.[13]
Nhà luyện kim người Đức Andreas Libavius đã nhận được một lượng vật liệu mà ông gọi là "calay" của Malabar từ một tàu chở hàng bắt được ở Bồ Đào Nha năm 1596.[122] Libavius đã miêu tả các thuộc tính của mẫu vật có thể là kẽm này. Kẽm thường được nhập khẩu đến châu Âu từ các nước phương Đông trong thế kỷ 17 và đầu thế kỷ 18,[116] nhưng rất đắt giá vào lúc đó.[note 3]
Tách kẽm nguyên chất

Việc tách kim loại kẽm ở phương Tây có thể đã đạt được những thành tựu một cách độc lập từ một số người. Universal Dictionary (Từ điển tổng hợp) của Postlewayt, một nguồn cung cấp thông tin kỹ thuật ở châu Âu, đã không đề cập đến kẽm trước năm 1751, nhưng nguyên tố này đã được nghiên cứu từ trước đó.[114][123]
Nhà luyện kim người Flanders là P.M. de Respour đã công bố rằng ông đã tách được kẽm kim loại từ kẽm ôxít năm 1668.[15] Sau đó, Étienne François Geoffroy đã miêu tả cách thức mà kẽm ôxít cô đặc lại thành các tinh thể màu vàng trên các thanh sắt được đặt bên trên các quặng kẽm đang nóng chảy.[15] Ở Anh, John Lane được cho là đã tiến hành các thí nghiệm để nung chảy kẽm, có thể ở Landore, trước khi ông phá sản năm 1726.[124]
Năm 1738, William Champion được cấp bằng sáng chế ở Đại Anh cho quá trình tách kẽm từ calamin trong một lò luyện theo kiểu bình cổ cong thẳng đứng.[125] Công nghệ của ông một phần nào đó giống với cách được sử dụng trong các mỏ kẽm ở Zawar thuộc Rajasthan nhưng không có bằng chứng nào cho thấy ông đã đến vùng phương đông.[126] Phương pháp của Champion được sử dụng suốt năm 1851.[116]
Nhà hóa học người Đức Andreas Marggraf được xem là có công trong việc phát hiện ra kẽm kim loại nguyên chất mặc dù nhà hóa học Thụy Điển là Anton von Swab đã chưng cất kẽm từ calamin 4 năm trước đó.[116] Trong thí nghiệm năm 1746 của ông, Marggraf đã nung hỗm hợp calamin và than củi trong một buồng kín không có đồng để lấy kim loại.[112] Quy trình này được ứng dụng ở quy mô thương mại từ năm 1752.[127]
Các công trình sau này

Một người anh em của William Champion là John đã nhận được bằng sáng chế năm 1758 về việc nung kẽm sulfua thành một ôxít có thể sử dụng trong quy trình chưng cất bằng lò cổ cong.[13] Trước đó chỉ có calamin mới có thể được sử dụng để sản xuất kẽm. Năm 1798, Johann Christian Ruberg cải tiến quá trình nung chảy bằng cách xây dựng một lò nung chưng cất nằm ngang.[128] Jean-Jacques Daniel Dony đã xây dựng một lò nung chảy nằm ngang theo một kiểu khác ở Bỉ, lò nung này có thể xử lý nhiều kẽm hơn.[116] Bác sĩ người Ý Luigi Galvani khám phá ra vào năm 1780 rằng việc kết nối tủy sống của một con ếch vừa mới mổ với một sợi sắt có gắn một cái mốc bằng đồng thau sẽ làm cho chân ếch co giật.[129] Ông ta đã nghĩ không chính xác rằng ông đã phát hiện một khả năng của nơ ron và cơ để tạo ra điện và gọi đó là hiệu ứng "điện động vật".[130] Tế bào mạ và quá trình mạ đều được đặt tên theo Luigi Galvani và những phát hiện này đã mở đường cho pin điện, mạ điện và chống ăn mòn điện.[130]
Bạn của Galvani là Alessandro Volta đã tiếp tục nghiên cứu hiệu ứng này và đã phát minh ra pin Volta năm 1800.[129] Đơn vị cơ bản của pin Volta là các tế bào mạ điện được đơn giản hóa, chúng được làm từ một tấm đồng và một tấm kẽm được gắn kết với nhhau ở bên ngoài và ngăn cách bởi một lớp điện ly. Các tấm này được xếp thành một chuỗi để tạo ra tế bào Volta, các tế bào này tạo ra điện bằng các dòng electron chạy từ tấm kẽm qua tấm đồng và cho phép kẽm ăn mòn.[129]
Tính chất không từ tính của kẽm và không màu của nó trong dung dịch đã làm trì hoãn việc phát hiện ra những tính chất quan trọng của chíng trong sinh hóa và dinh dưỡng.[131] Nhưng điều đó đã thay đổi vào năm 1940 khi mà cacbonic anhydrase, một loại enzym đẩy cacbon điôxít ra khỏi máu, đã cho thấy kẽm có vai trò quan trọng trong nó.[131] Enzym tiêu hóa carboxypeptidase là enzym chứa kẽm thứ hai được phát hiện năm 1955.[131]
Sản xuất
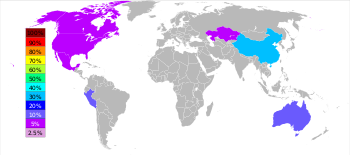
Khai thác mỏ và xử lý
| Hạng | Quốc gia | Tấn |
|---|---|---|
| 1 | 3,500,000 | |
| 2 | 1,520,000 | |
| 3 | 1,450,000 | |
| 4 | 750,000 | |
| 5 | 720,000 | |
| 6 | 670,000 |
Kẽm là kim loại được sử dụng phổ biến thứ 4 sau sắt, nhôm và đồng với sản lượng hàng năm khoảng 12 triệu tấn.[16] Nhà sản xuất kẽm lớn nhất thế giới là Nyrstar, công ty sáp nhập từ OZ Minerals của Úc và Umicore của Bỉ.[133] Khoảng 70% lượng kẽm trên thế giới có nguồn gốc từ khai thác mỏ, lượng còn lại từ hoạt động tái sử dụng.[134] Kẽm tinh khiết cấp thương mại có tên gọi trong giao dịch tiếng Anh là Special High Grade (SHG) có độ tinh khiết 99,995%.[135]
Trên toàn cầu, 95% kẽm được khai thác từ các mỏ quặng sulfua, trong đó ZnS luôn lẫn với đồng, chì và sắt sulfua.[136] Có nhiều mỏ kẽm trên khắp thế giới nhưng chủ yếu ở Trung Quốc, Úc và Peru. Trung Quốc sản xuất 29% lượng kẽm toàn cầu năm 2010.[16]
Kẽm kim loại được sản xuất bằng luyện kim khai khoáng.[137] Sau khi nghiền quặng, phương pháp tuyển nổi bọt được sử dụng để tách các khoáng dựa vào tính dính ướt khác nhau của chúng.[137] Ở bước cuối cùng này thì kẽm chiếm 50%, phần còn lại là lưu huỳnh (32%), sắt (13%), và SiO
2 (5%).[137]
Công đoạn thiêu kết sẽ chuyển kẽm sulfua thành kẽm ôxít:[136]
- 2 ZnS + 3 O
2 → 2 ZnO + 2 SO
2
Lưu huỳnh điôxít sinh ra sẽ được thu hồi để sản xuất axít sulfuric. Nếu các mỏ có loại khoáng sản khác là kẽm cacbonat, kẽm silicat hoặc kẽm spinel như ở mỏ Skorpion, Namibia thì không sử dụng công đoạn thiêu kết này.[138]
Sau đó, người ta có thể dùng 2 phương pháp cơ bản trong luyện kim là nhiệt luyện (pyrometallurgy) hoặc điện chiết (electrowinning). Quá trình nhiệt luyện khử kẽm ôxít với cacbon hoặc cacbon mônôxít ở 950 °C (1.740 °F) thành kim loại kẽm ở dạng hơi.[139] Hơi kẽm được thu hồi trong bình ngưng.[136] Quá trình được biểu diễn theo các phương trình dưới đây:[136]
- 2 ZnO + C → 2 Zn + CO
2 - 2 ZnO + 2 CO → 2 Zn + 2 CO
2
Quá trình điện chiết tách kẽm từ quặng tinh bằng axít sulfuric:[140]
- ZnO + H
2SO
4 → ZnSO
4 + H
2O
Sau đó, người ta dùng phương pháp điện phân để sản xuất kẽm kim loại.[136]
- 2 ZnSO
4 + 2 H
2O → 2 Zn + 2 H
2SO
4 + O
2
Axít sulfuric sinh ra được tái sử dụng trong trong bước trước đó.
Tác động môi trường
Quá trình sản xuất từ quặng kẽm sulfua thải ra một lượng lớn lưu huỳnh điôxít và hơi cadmi. Xỉ nóng chảy và các chất cặn khác trong quá trình sản xuất cũng chứa một lượng kim loại nặng đáng kể. Có khoảng 1,1 triệu tấn kẽm kim loại và 130 ngàn tấn chì đã được khai thác và nung chảy ở các thị trấn La Calamine và Plombières của Bỉ trong khoảng thời gian từ năm 1806 tới năm 1882.[141] Bãi thải của mỏ trước đây rò rỉ kẽm và cadmi, và các trầm tích trong sông Geul chứa một lượng kim loại nặng đáng kể.[141] Từ khoảng cách đây 2000 năm, lượng phát thải kẽm từ các nguồn khai thác mỏ và nung chảy đã thải ra tổng cộng 10 ngàn tấn mỗi năm. Đến năm 1850, lượng phát thải tăng lên gấp 10 lần, phát thải kẽm ở mức đỉnh vào khoảng 3,4 triệu tấn mỗi năm trong thập niên 1980 và giảm xuống 2,7 triệu tấn vào thập niên 1990, mặc dù theo một nghiên cứu năm 2005 về tầng đối lưu Bắc Cực chỉ ra rằng nồng độ kẽm không giảm. Các phát thải nhân tạo và tự nhiên xảy ra với tỷ lệ 20 trên 1.[142]
Hàm lượng kẽm trong các con sông chảy qua các khu công nghiệp và khu vực khai thác mỏ vào khoảng 20 ppm.[143] Công tác xử lý nước thải hiệu quả đã làm giảm đáng kể hàm lượng này; ví dụ như công tác xử lý nước thải dọc theo sông Rhine đã làm giảm lượng kẽm xuống còn 50 ppb.[143] Nồng độ kẽm ở mức 2 ppm ảnh hưởng xấu đến hàm lượng ôxy trong máu cá.[144]
Đất ô nhiễm kẽm từ hoạt động khai thác quặng chứa kẽm, tuyển, hoặc nơi sử dụng bùn chứa kẽm để làm phân, có thể chứa hàm lượng kẽm ở mức vài gam kẽm/kg đất khô. Hàm lượng kẽm trong đất cao hơn 500 ppm ảnh hưởng tới khả năng hấp thu các kim loại cần thiết khác của thực vật, như sắt và mangan. Kẽm ở mức 2.000 ppm đến 180.000 ppm (18%) đã được ghi nhận trong một số mẫu đất.[143]
Vai trò sinh học
Kẽm là nguyên tố cần thiết để duy trì sự sống của thực vật,[142] động vật,[147] và vi sinh vật,[148] Kẽm được tìm thấy trong gần 100 loại enzym đặc biệt[149] (các nguồn khác cho rằng tới 300), có vai trò là các ion cấu trúc trong yếu tố phiên mã và được lưu trữ và vận chuyển ở dạng thionein kim loại.[150] Nó là "kim loại chuyển tiếp phổ biến thứ 2 trong sinh vật" sau sắt và nó là kim loại duy nhất có mặt trong tất cả các lớp enzym.[142]
Trong các protein, các ion kẽm thường liên kết với các chuỗi amino axít của axít aspartic, axít glutamic, cystein và histidin.[151] Việc miêu tả lý thuyết và tính toán của các liên kết kẽm trong các protein này cũng như đối với các kim loại chuyển tiếp khác còn khó khăn.[151]
Có từ 2–4 gam kẽm[152] phân bố trong khắp cơ thể con người. Hầu hết kẽm nằm trong não, cơ, xương, thận và gan, tuy nhiên nồng độ kẽm cao nhất tập trung trong tuyến tiền liệt và các bộ phận của mắt.[153] Tinh dịch đặc biệt rất giàu kẽm, vì đây là yếu tố quan trọng trong chức năng của tuyến tiền liệt và giúp phát triển cơ quan sinh dục.[154]
Kẽm đóng vai trò sinh học quan trọng đối với con người.[4] Nó tương tác với một loạt các phối tử hữu cơ,[4] và có vai trò quan trọng trong quá trình trao đổi chất của RNA và DNA, truyền tín hiệu và biểu hiện gen. Nó cũng quyết định quá trình chết hoại tế bào. Một nghiên cứu năm 2006 ước tính rằng khoảng 10% protein người (2.800) có thể phụ thuộc vào kẽm, thêm vào đó hàng trăm protein vận chuyển kẽm; một nghiên cứu tương tự về in silico trong loài thực vật Arabidopsis thaliana đã tìm thấy 2.367 protein liên quan đến kẽm.[142]
Trong não, kẽm được lưu trữ trong các synaptic vesicles đặc biệt bởi các tế bào thần kinh glutamatergic[155] và có thể "điều chỉnh khả năng kích thích não".[4] Nó có vai trò quan trọng trong synaptic plasticity và cũng như trong việc học.[156] Tuy nhiên, nó được gọi là "ngựa đen của não" ("the brain's dark horse")[155] vì nó cũng có thể là một chất độc thần kinh, homeostasis kẽm đóng vai trò quan trọng trong chức năng bình thường của não và hệ thần kinh trung ương.[155]
Enzym


Kẽm là một axít Lewis, là một chất xúc tác có ích trong quá trình hydroxyl hóa và các phản ứng enzym khác.[149] Kim loại kẽm cũng là một chất có phối hợp hình học linh động, điều này cho phép các protein sử dụng nó để thay đổi cấu trúc protein một cách nhanh chóng để thực hiện các phản ứng sinh học.[157] Hai ví dụ về các enzym chứa kẽm là carbonic anhydrase và carboxypeptidase, đây là các enzym cần thiết trong các quá trình của chuyển hóa cacbon điôxít (CO
2) và tiêu hóa protein theo thứ tự.[158]
Trong máu của động vật có xương sống, carbonic anhydrase chuyển hóa CO
2 thành bicacbonat và cùng enzym đó chuyển bicacbonat trở lại thành CO
2 khi thở qua phổi.[159] Nếu không có enzym này, sự biến đổi này có thể diễn ra chậm hơn khoảng 1 triệu lần[160] đối với máu bình thường có pH là 7 hoặc không thì pH phải 10 hoặc lớn hơn.[161] Anhydrase không liên quan β-carbonic là cần thiết cho sự hình thành lá ở thực vật, sự tổng hợp indole axít acetic (auxin) và hô hấp kị khí (lên men rượu).[162]
Carboxypeptidase tách các liên kết peptit trong quá trình tiêu hóa protein. Liên kết cộng hóa trị phối hợp được tạo ra giữa các peptit đầu cuối và nhóm C=O gắn với kẽm, làm cho cacbon tích điện dương. Yếu tố này giúp tạo ra một hốc kị nước trên enzym gần kẽm, làm hút phần không phân cực của protein bị tiêu hóa.[158]
Các protein khác
Kẽm có vai trò cấu trúc toàn bộ trong cụm, xoắn và ngón tay kẽm.[163] Các kẽm finger tạo thành các bộ phận của một số yếu tố phiên mã (transcription factor), chúng là các protein nhận dạng trình tự DNA trong quá trình phiên mã và sao chép DNA. Mỗi ion Zn2+
thứ 9 hoặc 10 trong ngón tay kẽm giúp duy trình cấu trúc của các ngón tay bằng cách tạo liên kết với 4 amino axít trong nhân tố phiên mã.[160] Yếu tố phiên mã bao bọc xung quanh xoắn DNA và sử dụng các finger của nó để liên kết một cách chính xác với chuỗi DNA.
Trong huyết tương, kẽm bị ràng buộc và bị vận chuyển bởi albumin (60%, ái lực thấp) và transferrin (10%).[152] Vì transferrin cũng vận chuyển sắt, khi lượng sắt tăng quá cao làm giảm khả năng hấp thụ kẽm và ngược lại. Phản ứng tương tự cũng xảy ra đối với đồng.[164] Hàm lượng kẽm trong huyết tương ở mức tương đối ổn định bất kể lượng kẽm tiêu thụ vào là bao nhiêu.[165] Các tế bào trong tuyến nước bọt, tuyến tiền liệt, hệ miễn dịch và ruột sử dụng tín hiệu kẽm như là cách để liên lạc với các tế bào khác.[166]
Kẽm có thể được giữ trong thionein kim loại trong vi sinh vật hoặc trong ruột hoặc gan động vật.[167] Thionein kim loại trong các tế bào ruột có thể điều chỉnh sự hấp thụ kẽm khoảng 15–40%.[168] Tuy nhiên thiếu hoặc thừa kẽm có thể gây hại; đặc biệt thừa kẽm làm giảm hấp thụ đồng do thionein kim loại hấp thụ cả hai kim loại như đã phân tích ở trên.[169]
Chế độ ăn uống

Ở Mỹ, chế độ ăn chỉ định (Recommended Dietary Allowance - RDA) là 8 mg/ngày đối với nữ giới và 11 mg/ngày đối với nam giới.[170] Chế độ ăn trung bình ở Mỹ năm 2000 là 9 mg/ngày đối với nữ giới và 14 mg/ngày đối với nam giới.[171] Hàu, tôm hùm[172] và các loại thịt đỏ, đặc biệt là thịt bò, thịt cừu và gan bò là các thực phẩm có hàm lượng kẽm cao.[154]
Hàm lượng kẽm trong thực vật thay đổi tùy theo hàm lượng nguyên tố này trong đất. Khi đất có đủ lượng kẽm, thực phẩm từ thực vật chứa kẽm nhiều như lúa mì, và các loại hạt khác (mè, anh túc, cỏ linh lăng, cần tây, mù tạc).[173] Các nguồn thức ăn tự nhiên giàu kẽm khác bao gồm: các loại quả có nhân, ngũ cốc nguyên vẹn, hạt bí hay hạt hướng dương.[174]
Các nguồn khác trong thực phẩm tăng cường và chế độ ăn uống bổ sung cũng có nhiều dạng. Một báo cáo năm 1998 kết luận rằng kẽm ôxít, là một trong những chất bổ sung phổ biến nhất ở Mỹ, và kẽm cacbonat là loại gần như không hòa tan và kém được hấp thu trong cơ thể.[175] Bài báo này trích dẫn các nghiên cứu phát hiện rằng các hàm lượng kẽm plasma thấp sau khi ăn kẽm ôxít và kẽm cacbonat so với những trường hợp sau khi tiêu thụ kẽm acetat và kẽm sulfat.[175] Tuy nhiên, bổ sung kẽm vượt mức gây hại là một vấn đề trong số những người tương đối giàu, và có thể không nên vượt quá 20 mg/ngày ở người khỏe mạnh,[176] mặc dù Hội đồng Nghiên cứu quốc gia Hoa Kỳ đưa ra mức trần là 40 mg/ngày.[177]
Sự thiếu hụt kẽm để lại những hiệu ứng rõ nét trong việc tăng trọng của động vật. Kẽm tìm thấy trong insulin, các protein chứa kẽm và các enzym như superôxít dismutas.
Theo một số nguồn thì việc sử dụng các loại thuốc chứa kẽm có thể đem lại sự miễn dịch đối với cảm lạnh hay cúm, mặc dù điều này còn gây tranh cãi.
Thị giác, vị giác, khứu giác và trí nhớ có liên quan đến kẽm và sự thiếu hụt kẽm có thể gây ra sự hoạt động không bình thường của các cơ quan này.
Ở đàn ông, kẽm rất quan trọng trong việc sản xuất tinh dịch. Tới 5 mg kẽm bị mất đi trong quá trình xuất tinh. Thiếu hụt kẽm ở đàn ông có thể dẫn tới giảm lượng tinh trùng và tần xuất tình dục. Sự xuất tinh thường xuyên có thể dẫn tới thiếu hụt kẽm.
Thiếu kẽm
Thiếu kẽm thường là do dinh dưỡng thiếu kẽm, nhưng cũng có thể liên quan đến sự hấp thu kẽm kém, acrodermatitis enteropathica, bệnh gan mãn tính, bệnh thận mãn tính, hồng cầu lưỡi liềm, tiểu đường, bệnh ác tính và các bệnh mãn tính khác.[5] Các triệu chứng thiếu kẽm nhẹ rất đa dạng.[171] Biểu hiện lâm sàng bao gồm chậm tăng trưởng, tiêu chảy, bất lực và chậm phát dục, rụng tóc, tổn thương da và mắt, giảm cảm giác ngon miệng, thay đổi nhận thức, làm suy giảm khả năng bảo vệ của cơ thể, khiếm khuyết trong việc sử dụng carbohydrat, và sinh quái thai.[165] Thiếu kẽm nhẹ làm giảm miễn dịch,[178] mặc dù dư thừa kẽm cũng giảm miễn dịch.[152] Động vật có chế độ ăn thiếi kẽm thì cần lượng thức ăn tăng gấp đôi để bù lại lượng kẽm so với các động vật được cung cấp đủ kẽm.[72]
Các nhóm có nguy cơ thiếu kẽm bao gồm người già, và những người suy thận. Kẽm chelat phytat được tìm thấy trong hạt và ngũ cốc cám có thể góp phần vào việc kém hấp thu kẽm.[5]
Mặc dù có những lo ngại,[179] nhưng những người ăn chay phương Tây không được phát hiện là thiếu hụt kẽm nhiều so với những người ăn thịt.[180] Các nguồn thực vật cung cấp kẽm như đậu khô, rau biển, ngũ cốc tăng cường, thực phẩm từ đậu nành, đậu phụng, các loại hạt, đậu Hà Lan, mầm hạt.[179] Tuy nhiên, phytat trong nhiều loại hạt và chất xơ trong thực phẩm có thể ảnh hưởng đến việc hấp thụ kẽm và uống kẽm gần giới hạn biên có các hiệu ứng chưa được rõ. Có một vài bằng chứng cho thấy rằng sử dụng lượng kẽm nhiều hơn so với tiêu chuẩn của US RDA (15 mg) hàng ngày có thể là cần thiết cho những người có chế độ ăn uống mà phytat cao, như một số người ăn chay.[179] Việc tính toán này phải được cân đối với thực tế rằng có một lượng ít ỏi các chỉ số sinh học kẽm đầy đủ, và là chỉ số được sử dụng rộng rãi nhất, kẽm plasma, có độ nhạy và độ đặc hiệu kém.[181] Chẩn đoán thiếu kẽm là một thách thức lâu dài.[4]
Gần 2 tỉ người ở các nước đang phát triển bị thiếu kẽm.[5] Ở trẻ em, thiếu kẽm làm gia tăng nhiễm trùng và tiêu chảy làm khoảng 800.000 trẻm em thiệt mạng mỗi năm trên toàn cầu.[4] WHO có chủ trương bổ sung kẽm cho trẻ suy dinh dưỡng nặng và tiêu chảy.[182] Bổ sung kẽm giúp ngăn ngừa bệnh tật và giảm tử vong, đặc biệt là trẻ em sinh thiếu cân hoặc chậm phát triển.[182] Tuy nhiên, bổ sung kẽm không nên được phân phối một cách riêng lẻ vì một số trường hợp thiếu kẽm ở các quốc gia đang phát triển có thể liên quan đến sự tương tác của kẽm với các vi chất dinh dưỡng khác.[183]
Thiếu kẽm là trường hợp thiếu vi chất dinh dưỡng phổ biến nhất ở thực vật, đặc biệt là trong đất có độ pH cao. Đất thiếu kẽm được canh tác trong các cánh đồng của phân nửa Thổ Nhĩ Kỳ và Ấn Độ, 1/3 ở Trung Quốc và hầu hết miền Tây Úc, và có những phản hồi đáng kể về việc bổ sung phân kẽm đã được báo cáo ở các khu vực này.[142] Thực vật phát triển trong các loại đất thiếu kẽm dễ bị mắc bệnh hơn. Kẽm về cơ bản được bổ sung vào đất thông qua quá trình phong hóa từ các loại đá, nhưng con người đã đưa kẽm vào trong đất qua quá trình đốt nhiên liệu hóa thạch, chất thải mỏ, phân lân, đá vôi, phân, bùn thải và các hạt từ các bề mặt mạ kẽm. Kẽm dư thừa là chất độc đối với cây, mặc dù độ độc của kẽm ít phổ biến.[142]
Cảnh báo
Độc tính
Mặc dù kẽm là vi chất cần thiết cho sức khỏe, tuy nhiên nếu hàm lượng kẽm vượt quá mức cần thiết sẽ có hại cho sức khỏe. Hấp thụ quá nhiều kẽm làm ngăn chặn sự hấp thu đồng và sắt.[169] Ion kẽm tự do trong dung dịch là chất có độc tính cao đối với thực vật, động vật không xương sống, và thậm chí là cả động vật có xương sống.[184] Mô hình hoạt động của ion tự do đã được công bố trong một số ấn phẩm, cho thấy rằng chỉ một lượng mỏ mol ion kẽm tự do cũng giết đi một số sinh vật. Một thí nghiệm gần đây cho thấy 6 micromol giết 93% Daphnia trong nước.[185]
Ion kẽm tự do là một axít Lewis mạnh đến mức có thể ăn mòn. Axít dịch vị chứa axít clohydric, mà hàm lượng kẽm kim loại trong đó dễ hòa tan trong đó gây ăn mòn kẽm clorua. Nuốt đồng xu 1 cent của Mỹ năm 1982 (97,5% kẽm) có thể làm hỏng niêm mạc dạ dày do khả năng hòa tan cao của các ion kẽm trong dịch vị.[186]
Có bằng chứng về sự thiếu hụt đồng khi uống ở mức thấp một lượng kẽm 100–300 mg/ngày; một thử nghiệm gần đây cho thấy số người nhập viện cao hơn liên quan đến các biến chứng tiết niệu so với "thuốc trấn an" trong số đàn ông lớn tuổi uống 80 mg/day.[187] USDA RDA khuyến khích uống 11 và 8 mg Zn/ngày theo thứ tự đối với đàn ông và phụ nữ.[170] Thậm chí ở các mức thấp hơn, gần với tiêu chuẩn RDA, có thể can thiệp với việc uống đồng và sắt, chống lại ảnh hưởng của cholesterol.[169] Hàm lượng kẽm vượt quá 500 ppm trong đất gây rối cho khả năng hấp thụ các kim loại cần thiết khác của thực vật, như sắt và mangan.[143] Có những tình huống gọi là sự run kẽm hay ớn lạnh kẽm sinh ra do hít phải các dạng bột ôxít kẽm nguyên chất.[72]
Cơ quan quản lý thuốc và thực phẩm Hoa Kỳ (FDA) đã khuyến cáo rằng kẽm phá hủy các thụ thể thần kim trong mũi gây ra chứng mất khứu giác. Các báo cáo về chứng mất khứu giác cũng được quan sát trong thập niên 1930 khi các công tác chuẩn bị kẽm để sử dụng trong một nỗ lực không thành công để ngăn chặn sự lây nhiễm bệnh bại liệt.[188] Ngày 16 tháng 6 năm 2009, FDA thông báo rằng những người sử dụng kẽm nên dừng sử dụng các sản phẩm trị cúm có gốc kẽm và yêu cầu loại bỏ các sản phẩm đó trong các cửa hàng. FDA nói rằng việc không cảm nhận được mùi có thể đe dọa đời sống vì người dân không thể cảm nhận được sự rò rỉ của gas hoặc khói và không thể nhận biết rằng thực phẩm có bị hư trước khi họ ăn.[189]
Ngộ độc
Năm 1982, United States Mint bắt đầu đúc xu bằng đồng mạ kẽm nhưng chủ yếu là làm từ kẽm. Với các đồng kẽm mới, có khả năng gây ngộ độc kẽm, và có thể gây tử vong. Một trường hợp ăn liên tục trong thời gian dài 425 đồng xu kẽm (hơn 1 kg kẽm) gây tử vong do nhiễm vi khuẩn đường ruột và nhiễm trùng máu, trong khi một bệnh nhân khác ăn 12 gram kẽm chỉ cho thấy hôn mê và bất động.[190] Một số ca khác liên quan đến ngộ độ kẽm từ việc nuốt các đồng xu kẽm cũng được ghi nhận.[191][192]
Các con chó đôi khi cũng nuốt các đồng xu và chỉ có cách dùng thuốc để loại chúng ra khỏi cơ thể. Hàm lượng kẽm trong một số đồng xu có thể gây ra ngộ độc kẽm, mà thường gây tử vong ở chó, vì nó gây ra các chứng thiếu máu (hemolytic anemia) nghiêm trọng, và cũng làm cho gan và thận bị tổn thương; các chứng nôn mữa và tiêu chảy.[193] Kẽm có độc tính cao đối với vẹt và sự ngộ độc có thể làm chết chúng.[194] Việc cho các con vẹt uống các loại nước ép trái cây trong các hộp mạ kẽm có thể làm cho chúng bị ngộ độc kẽm hàng loạt.[89]
Ghi chú
- ^ Electric current will naturally flow between zinc and steel but in some circumstances inert anodes are used with an external DC source.
- ^ In clinical trials, both zinc gluconate and zinc gluconate glycine (the formulation used in lozenges) have been shown to shorten the duration of symptoms of the common cold.
- Godfrey, J. C. (1996). “Zinc for treating the common cold: Review of all clinical trials since 1984”. Alternative Therapies in Health and Medicine. 2 (6): 63–72. PMID 8942045. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp)
- Hulisz, Darrell T. “Zinc and the Common Cold: What Pharmacists Need to Know”. US Pharmacist. uspharmacist.com. Truy cập ngày 9 tháng 4 năm 2012.
- Godfrey, J. C. (1996). “Zinc for treating the common cold: Review of all clinical trials since 1984”. Alternative Therapies in Health and Medicine. 2 (6): 63–72. PMID 8942045. Đã bỏ qua tham số không rõ
- ^ Một tàu của Công ty Đông Ấn chở các hàng hóa là kim loại kẽm gần như nguyên chất từ phương Đông đã chìm ngoài khơi bờ biển Thụy Điển năm 1745.(Emsley 2001, tr. 502)
Tham khảo
- ^ Standard Atomic Weights 2013. Ủy ban Trọng lượng Nguyên tử và Đa dạng Đồng vị
- ^ Được cho là trải qua phân rã β+β+ thành 64Ni với chu kỳ bán rã hơn 2,3×1018 năm.
- ^ Được cho là trải qua phân rã β−β− thành 70Ge với chu kỳ bán rã hơn 1,3×1016 năm.
- ^ a b c d e f g Hambidge, K. M. and Krebs, N. F. (2007). “Zinc deficiency: a special challenge”. J. Nutr. 137 (4): 1101. PMID 17374687. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp)Quản lý CS1: nhiều tên: danh sách tác giả (liên kết) - ^ a b c d Prasad, A. S. (2003). “Zinc deficiency : Has been known of for 40 years but ignored by global health organisations”. British Medical Journal. 326 (7386): 409. doi:10.1136/bmj.326.7386.409. PMC 1125304. PMID 12595353. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp) - ^ a b c d e f g h i j CRC 2006, tr. 4–41
- ^ a b Heiserman 1992, tr. 123
- ^ Lehto 1968, tr. 826
- ^ Scoffern, John (1861). The Useful Metals and Their Alloys. Houlston and Wright. tr. 591–603. Truy cập ngày 6 tháng 4 năm 2009.
- ^ a b “Zinc Metal Properties”. American Galvanizers Association. 2008. Truy cập ngày 15 tháng 2 năm 2009.
- ^ Ingalls, Walter Renton (1902). Production and Properties of Zinc: A Treatise on the Occurrence and Distribution of Zinc Ore, the Commercial and Technical Conditions Affecting the Production of the Spelter, Its Chemical and Physical Properties and Uses in the Arts, Together with a Historical and Statistical Review of the Industry. The Engineering and Mining Journal. tr. 142–6.
- ^ a b c d Emsley 2001, tr. 503
- ^ a b c d e Lehto 1968, tr. 822
- ^ a b c Greenwood 1997, tr. 1202
- ^ a b c d Emsley 2001, tr. 502
- ^ a b c d Tolcin, A. C. (2011). “Mineral Commodity Summaries 2009: Zinc” (PDF). United States Geological Survey. Truy cập ngày 6 tháng 6 năm 2011.
- ^ “Country Partnership Strategy—Iran: 2011–12”. ECO Trade and development bank. Truy cập ngày 6 tháng 6 năm 2011.
- ^ “IRAN – a growing market with enormous potential”. IMRG. 5 tháng 7 năm 2010. Truy cập ngày 3 tháng 3 năm 2010.
- ^ Cohen, David (2007). “Earth audit”. New Scientist. 194 (2605): 8. doi:10.1016/S0262-4079(07)61315-3.
- ^ “Augsberg University Calculate When Our Materials Run Out - Soon”. IDTechEx. 4 tháng 6 năm 2007. Truy cập ngày 9 tháng 12 năm 2008.
- ^ Gordon, R. B. (2006). “Metal stocks and sustainability”. Proceedings of the National Academy of Sciences. 103 (5): 1209. Bibcode:2006PNAS..103.1209G. doi:10.1073/pnas.0509498103. PMC 1360560. PMID 16432205. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ a b c d e f NNDC contributors (2008). Alejandro A. Sonzogni (Database Manager) (biên tập). “Chart of Nuclides”. Upton (NY): National Nuclear Data Center, Phòng thí nghiệm quốc gia Brookhaven. Truy cập ngày 13 tháng 9 năm 2008.
- ^ CRC 2006, tr. 11–70
- ^ NASA contributors. “Five-Year Wilkinson Microwave Anisotropy Probe (WMAP) Observations: Data Processing, Sky Maps, and Basic Results” (PDF). NASA. Truy cập ngày 6 tháng 3 năm 2008.
- ^ Audi, Georges (2003). “The NUBASE Evaluation of Nuclear and Decay Properties”. Nuclear Physics A. Atomic Mass Data Center. 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ CRC 2006, tr. 8–29
- ^ Porter, Frank C. (1994). Corrosion Resistance of Zinc and Zinc Alloys. CRC Press. tr. 121. ISBN 0824792130.
- ^ a b c d e f g h Holleman, Arnold F. (1985). “Zink”. Lehrbuch der Anorganischen Chemie (bằng tiếng German) . Walter de Gruyter. tr. 1034–1041. ISBN 3-11-007511-3. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp)Quản lý CS1: dấu chấm câu dư (liên kết) Quản lý CS1: ngôn ngữ không rõ (liên kết) - ^ Hinds, John Iredelle Dillard (1908). Inorganic Chemistry: With the Elements of Physical and Theoretical Chemistry (ấn bản 2). New York: John Wiley & Sons. tr. 506–508.
- ^ Ritchie, Rob (2004). Chemistry (ấn bản 2). Letts and Lonsdale. tr. 71. ISBN 1843154382.
- ^ Jaffe, Howard W. (1996). Crystal Chemistry and Refractivity. Courier Dover Publications. tr. 31. ISBN 048669173X.
- ^ Burgess, John (1978). Metal ions in solution. New York: Ellis Horwood. tr. 147. ISBN 0470262931.
- ^ Brady, James E. (1983). General Chemistry: Principles and Structure (ấn bản 3). John Wiley & Sons. tr. 671. ISBN 047186739X. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Kaupp M.; Dolg M.; Stoll H.; Von Schnering H. G. (1994). “Oxidation state +IV in group 12 chemistry. Ab initio study of zinc(IV), cadmium(IV), and mercury(IV) fluorides”. Inorganic chemistry. 33 (10): 2122. doi:10.1021/ic00088a012.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ a b Greenwood 1997, tr. 1206
- ^ CRC 2006, tr. 12–11–12
- ^ “Zinc Sulfide”. American Elements. Truy cập ngày 3 tháng 2 năm 2009.
- ^ Grolier contributors (1994). Academic American Encyclopedia. Danbury, Connecticut: Grolier Inc. tr. 202. ISBN 0717220532.
- ^ “Zinc Phosphide”. American Elements. Truy cập ngày 3 tháng 2 năm 2009.
- ^ Shulzhenko, A. A. (2000). “Peculiarities of interaction in the Zn–C system under high pressures and temperatures”. Diamond and Related Materials. 9 (2): 129. doi:10.1016/S0925-9635(99)00231-9. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Greenwood 1997, tr. 1211
- ^ Rasmussen, J. K. (1990). “In situ Cyanosilylation of Carbonyl Compounds: O-Trimethylsilyl-4-Methoxymandelonitrile”. Organic Syntheses, Collected Volume. 7: 521. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Perry, D. L. (1995). Handbook of Inorganic Compounds. CRC Press. tr. 448–458. ISBN 0849386713.
- ^ Frankland E. (1850). “On the isolation of the organic radicals”. Quarterly Journal of the Chemical Society. 2 (3): 263. doi:10.1039/QJ8500200263.
- ^ Resa, I. (2004). “Decamethyldizincocene, a Stable Compound of Zn(I) with a Zn-Zn Bond”. Science. 305 (5687): 1136. Bibcode:2004Sci...305.1136R. doi:10.1126/science.1101356. PMID 15326350. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ Greenwood 1997, tr. 1203
- ^ a b “Zinc: World Mine Production (zinc content of concentrate) by Country” (PDF). 2009 Minerals Yearbook: Zinc. Washington, D.C.: United States Geological Survey. tháng 2 năm 2010. Truy cập ngày 6 tháng 6 năm 2010.
- ^ a b Stwertka 1998, tr. 99
- ^ a b c d e f g Lehto 1968, tr. 829
- ^ Bounoughaz, M. (2003). “A comparative study of the electrochemical behaviour of Algerian zinc and a zinc from a commercial sacrificial anode”. Journal of Materials Science. 38 (6): 1139. doi:10.1023/A:1022824813564. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Besenhard, Jürgen O. (1999). Handbook of Battery Materials (PDF). Wiley-VCH. ISBN 3-527-29469-4. Truy cập ngày 8 tháng 10 năm 2008.
- ^ Wiaux, J. -P. (1995). “Recycling zinc batteries: an economical challenge in consumer waste management”. Journal of Power Sources. 57 (1–2): 61. doi:10.1016/0378-7753(95)02242-2. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Culter, T. (1996). “A design guide for rechargeable zinc-air battery technology”. Southcon/96. Conference Record: 616. doi:10.1109/SOUTHC.1996.535134. ISBN 0-7803-3268-7.
- ^ Whartman, Jonathan. “Zinc Air Battery-Battery Hybrid for Powering Electric Scooters and Electric Buses” (PDF). The 15th International Electric Vehicle Symposium. Truy cập ngày 8 tháng 10 năm 2008. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Cooper, J. F. “A refuelable zinc/air battery for fleet electric vehicle propulsion”. Society of Automotive Engineers future transportation technology conference and exposition. Truy cập ngày 8 tháng 10 năm 2008. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Bush, Douglas Earl (2006). The Organ: An Encyclopedia. Routledge. tr. 679. ISBN 978-0-415-94174-7. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp) - ^ “Coin Specifications”. United States Mint. Truy cập ngày 8 tháng 10 năm 2008.
- ^ Jasinski, Stephen M. “Mineral Yearbook 1994: Zinc” (PDF). United States Geological Survey. Truy cập ngày 13 tháng 11 năm 2008.
- ^ Eastern Alloys contributors. “Diecasting Alloys”. Maybrook, NY: Eastern Alloys. Truy cập ngày 19 tháng 1 năm 2009.
- ^ Apelian, D. (1981). “Casting with Zinc Alloys”. Journal of Metals. 33: 12–19. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Davies, Geoff (2003). Materials for automobile bodies. Butterworth-Heinemann. tr. 157. ISBN 0-7506-5692-1.
- ^ Samans, Carl Hubert (1949). Engineering Metals and Their Alloys. Macmillan Co.
- ^ a b Porter, Frank (1994). “Wrought Zinc”. Corrosion Resistance of Zinc and Zinc Alloys. CRC Press. tr. 6–7. ISBN 978-0-8247-9213-8.
- ^ McClane, Albert Jules and Gardner, Keith (1987). The Complete book of fishing: a guide to freshwater, saltwater & big-game fishing. Gallery Books. ISBN 978-0-8317-1565-6. Truy cập ngày 26 tháng 6 năm 2012.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ “Cast flywheel on old Magturbo trainer has been recalled since July 2000”. Minoura.
- ^ a b c Katz, Johnathan I. (2002). The Biggest Bangs. Oxford University Press. tr. 18. ISBN 0-19-514570-4.
- ^ Zhang, Xiaoge Gregory (1996). Corrosion and Electrochemistry of Zinc. Springer. tr. 93. ISBN 0-306-45334-7.
- ^ Weimer, Al (17 tháng 5 năm 2006). “Development of Solar-powered Thermochemical Production of Hydrogen from Water” (PDF). U.S. Department of Energy. Truy cập ngày 10 tháng 1 năm 2009.
- ^ a b c Heiserman 1992, tr. 124
- ^ Blew, Joseph Oscar (1953). “Wood preservatives” (PDF). Department of Agriculture, Forest Service, Forest Products Laboratory. hdl:1957/816.
- ^ Frankland, Edward (1849). “Notiz über eine neue Reihe organischer Körper, welche Metalle, Phosphor u. s. w. enthalten”. Liebig's Annalen der Chemie und Pharmacie (bằng tiếng German). 71 (2): 213. doi:10.1002/jlac.18490710206.Quản lý CS1: ngôn ngữ không rõ (liên kết)
- ^ a b c CRC 2006, tr. 4-42
- ^ Paschotta, Rüdiger (2008). Encyclopedia of Laser Physics and Technology. Wiley-VCH. tr. 798. ISBN 3-527-40828-2.
- ^ Konstantinou, I. K. (2004). “Worldwide occurrence and effects of antifouling paint booster biocides in the aquatic environment: a review”. Environment International. 30 (2): 235. doi:10.1016/S0160-4120(03)00176-4. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ a b c Boudreaux, Kevin A. “Zinc + Sulfur”. Angelo State University. Truy cập ngày 8 tháng 10 năm 2008.
- ^ “Technical Information”. Zinc Counters. 2008. Truy cập ngày 29 tháng 11 năm 2008.
- ^ a b c Win, David Tin (2003). “Weapons of Mass Destruction” (PDF). Assumption University Journal of Technology. Assumption University. 6 (4): 199. Truy cập ngày 6 tháng 4 năm 2009. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ David E. Newton (1999). Chemical Elements: From Carbon to Krypton. U. X. L. /Gale. ISBN 0-7876-2846-8. Truy cập ngày 6 tháng 4 năm 2009.
- ^ Ullmann's Agrochemicals. Wiley-Vch (COR). 2007. tr. 591–592. ISBN 3-527-31604-3.
- ^ Walker, J. C. F. (2006). Primary Wood Processing: Principles and Practice. Springer. tr. 317. ISBN 1-4020-4392-9.
- ^ “ZDDP Engine Oil – The Zinc Factor”. Mustang Monthly. Truy cập ngày 19 tháng 9 năm 2009.
- ^ a b DiSilvestro, Robert A. (2004). Handbook of Minerals as Nutritional Supplements. CRC Press. tr. 135, 155. ISBN 0-8493-1652-9.
- ^ a b Milbury, Paul E. (2008). Understanding the Antioxidant Controversy: Scrutinizing the "fountain of Youth". Greenwood Publishing Group. tr. 99. ISBN 0-275-99376-0. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Keen, CL; Gershwin, ME (1990). “Zinc deficiency and immune function”. Annual review of nutrition. 10: 415–31. doi:10.1146/annurev.nu.10.070190.002215. PMID 2200472.
- ^ “Zinc and Health : The Common Cold”. Office of Dietary Supplements, National Institutes of Health. Truy cập ngày 1 tháng 5 năm 2010.
- ^ Singh M, Das RR. (2011). Singh, Meenu (biên tập). “Zinc for the common cold”. Cochrane Database of Systematic Reviews. 2 (2): CD001364. doi:10.1002/14651858.CD001364.pub3. PMID 21328251.
- ^ Bhutta, ZA; Bird, SM; Black, RE; Brown, KH; Gardner, JM; Hidayat, A; Khatun, F; Martorell, R; Ninh, NX (2000). “Therapeutic effects of oral zinc in acute and persistent diarrhea in children in developing countries: pooled analysis of randomized controlled trials”. The American journal of clinical nutrition. 72 (6): 1516–22. PMID 11101480.
- ^ Age-Related Eye Disease Study Research Group (2001). “A Randomized, Placebo-Controlled, Clinical Trial of High-Dose Supplementation With Vitamins C and E, Beta Carotene, and Zinc for Age-Related Macular Degeneration and Vision Loss: AREDS Report No. 8”. Arch Ophthalmology. 119 (10): 1417–36. doi:10.1001/archopht.119.10.1417. PMC 1462955. PMID 11594942.
- ^ a b c d e f Emsley 2001, tr. 501
- ^ Aydemir, T. B. (2006). “Zinc supplementation of young men alters metallothionein, zinc transporter, and cytokine gene expression in leukocyte populations”. PNAS. 103 (6): 1699–704. Bibcode:2006PNAS..103.1699A. doi:10.1073/pnas.0510407103. PMC 1413653. PMID 16434472. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp) - ^ Valko, M. (2005). “Metals, Toxicity and Oxidative stress”. Current Medicinal Chemistry. 12 (10): 1161–208. doi:10.2174/0929867053764635. PMID 15892631. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Venkatratnam, Abhishek (1 tháng 7 năm 2011). “Zinc Reduces the Detection of Cocaine, Methamphetamine, and THC by ELISA Urine Testing”. Journal of Analytical Toxicology. 35 (6): 333–340. doi:10.1093/anatox/35.6.333. PMID 21740689. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Lỗi Lua trong Mô_đun:Citation/CS1/Utilities tại dòng 76: bad argument #1 to 'message.newRawMessage' (string expected, got nil).
- ^ Leitzmann, M. F.; Stampfer, M. J.; Wu, K.; Colditz, G. A.; Willett, W. C.; Giovannucci, E. L. (2003). “Zinc Supplement Use and Risk of Prostate Cancer”. JNCI Journal of the National Cancer Institute. 95 (13): 1004. doi:10.1093/jnci/95.13.1004.
- ^ Roldán, S.; Winkel, E. G.; Herrera, D.; Sanz, M.; Van Winkelhoff, A. J. (2003). “The effects of a new mouthrinse containing chlorhexidine, cetylpyridinium chloride and zinc lactate on the microflora of oral halitosis patients: a dual-centre, double-blind placebo-controlled study”. Journal of Clinical Periodontology. 30 (5): 427. doi:10.1034/j.1600-051X.2003.20004.x.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Marks, R. (1985). “The effects of a shampoo containing zinc pyrithione on the control of dandruff”. British Journal of Dermatology. 112 (4): 415. doi:10.1111/j.1365-2133.1985.tb02314.x. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ McCarthy, T J (1 tháng 2 năm 1992). “The antimicrobial action of zinc ion/antioxidant combinations”. Clinical Pharmacology & Therapeutics. American Society for Clinical Pharmacology and Therapeutics. 17 (1): 5. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Overman, Larry E.; Carpenter, Nancy E. (2005). “Organic Reactions”. doi:10.1002/0471264180.or066.01. ISBN 0-471-26418-0. Chú thích journal cần
|journal=(trợ giúp);|chapter=bị bỏ qua (trợ giúp) - ^ Rappoport, Zvi; Marek, Ilan (17 tháng 12 năm 2007). The Chemistry of Organozinc Compounds: R-Zn. ISBN 0-470-09337-4.
- ^ Knochel, Paul; Jones, Philip (1999). Organozinc reagents: A practical approach. ISBN 0-19-850121-8.
- ^ Herrmann, Wolfgang A (tháng 1 năm 2002). Synthetic Methods of Organometallic and Inorganic Chemistry: Catalysis. ISBN 3-13-103061-5.
- ^ “Frankland-Duppa Reaction”. Truy cập ngày 13 tháng 2 năm 2012.
- ^ Kim, Jeung Gon; Walsh, Patrick J. (2006). “From Aryl Bromides to Enantioenriched Benzylic Alcohols in a Single Flask: Catalytic Asymmetric Arylation of Aldehydes”. Angewandte Chemie International Edition. 45 (25): 4175. doi:10.1002/anie.200600741.
- ^ In this one-pot reaction bromobenzene is converted to phenyllithium by reaction with 4 equivalents of n-butyllithium, then transmetalation with zinc chloride forms diphenylzinc which continues to react in an asymmetric reaction first with the MIB ligand and then with 2-naphthylaldehyde to the alcohol. In this reaction formation of diphenylzinc is accompanied by that of lithium chloride, which unchecked, catalyses the reaction without MIB involvement to the racemic alcohol. The salt is effectively removed by chelation with tetraethylethylene diamine (TEEDA) resulting in an enantiomeric excess of 92%.
- ^ Weeks 1933, tr. 20
- ^ Rehren, Th. (1996). S. Demirci; và đồng nghiệp (biên tập). A Roman zinc tablet from Bern, Switzerland: Reconstruction of the Manufacture. Archaeometry 94. The Proceedings of the 29th International Symposium on Archaeometry. tr. 35–45. “Và đồng nghiệp” được ghi trong:
|editor=(trợ giúp) - ^ Craddock, P. T. (1998). “Zinc in classical antiquity”. Trong Craddock, P.T. (biên tập). 2000 years of zinc and brass . London: British Museum. tr. 3–5. ISBN 0861591240.
- ^ Craddock P. T.; và đồng nghiệp (1998). “Zinc in India”. 2000 years of zinc and brass . London: British Museum. tr. 27. ISBN 0861591240. “Và đồng nghiệp” được ghi trong:
|author=(trợ giúp) - ^ Greenwood 1997, tr. 1201
- ^ “How is zinc made?”. How Products are Made. The Gale Group. 2002. Truy cập ngày 21 tháng 2 năm 2009.
- ^ Chambers 1901, tr. 799
- ^ a b Weeks 1933, tr. 21
- ^ a b Tr. 46, Ancient mining and metallurgy in Rajasthan, S. M. Gandhi, chương 2 trong Crustal Evolution and Metallogeny in the Northwestern Indian Shield: A Festschrift for Asoke Mookherjee, M. Deb (chủ biên), Alpha Science Int'l Ltd., 2000, ISBN 1-84265-001-7.
- ^ a b c Craddock, P. T. (1983). “Zinc production in medieval India”. World Archaeology. Taylor & Francis. 15 (2): 211. doi:10.1080/00438243.1983.9979899. JSTOR 124653. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ Ray, Prafulla Chandra (1903). A History of Hindu Chemistry from the Earliest Times to the Middle of the Sixteenth Century, A.D.: With Sanskrit Texts, Variants, Translation and Illustrations. 1 (ấn bản 2). The Bengal Chemical & Pharmaceutical Works, Ltd. tr. 157–158. (public domain text)
- ^ a b c d e f g Habashi, Fathi. “History of Zinc”. International Zinc Association (IZA). Truy cập ngày 4 tháng 12 năm 2012. Kiểm tra giá trị ngày tháng trong:
|accessdate=(trợ giúp) - ^ Arny, Henry Vinecome (1917). Principles of Pharmacy (ấn bản 2). W. B. Saunders company. tr. 483.
- ^ Hoover, Herbert Clark (2003). Georgius Agricola de Re Metallica. Kessinger Publishing. tr. 409. ISBN 0-7661-3197-1.
- ^ Gerhartz, Wolfgang (1996). Ullmann's Encyclopedia of Industrial Chemistry (ấn bản 5). VHC. tr. 509. ISBN 3-527-20100-9. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Skeat, W. W (2005). Concise Etymological Dictionary of the English Language. Cosimo, Inc. tr. 622. ISBN 1-59605-092-6.
- ^ Fathi Habashi (1997). Handbook of Extractive Metallurgy. Wiley-VHC. tr. 642. ISBN 3-527-28792-2.
- ^ Lach, Donald F. (1994). “Technology and the Natural Sciences”. Asia in the Making of Europe. University of Chicago Press. tr. 426. ISBN 0-226-46734-1.
- ^ Willies, Lynn; và đồng nghiệp (1984). “Ancient Lead and Zinc Mining in Rajasthan, India”. World Archaeology. 16 (2, Mines and Quarries): 222. doi:10.1080/00438243.1984.9979929. JSTOR 124574. “Và đồng nghiệp” được ghi trong:
|author=(trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ Roberts, R. O. (1951). “Dr John Lane and the foundation of the non-ferrous metal industry in the Swansea valley”. Gower. Gower Society (4): 19.
- ^ Comyns, Alan E. (2007). Encyclopedic Dictionary of Named Processes in Chemical Technology (ấn bản 3). CRC Press. tr. 71. ISBN 0-8493-9163-6.
- ^ Jenkins, Rhys (1945–7). “The Zinc Industry in England: the early years up to 1850”. Transactions of the Newcomen Society. 25: 41–52. Kiểm tra giá trị ngày tháng trong:
|year=(trợ giúp) - ^ Heiserman 1992, tr. 122
- ^ Gray, Leon (2005). Zinc. Marshall Cavendish. tr. 8. ISBN 0-7614-1922-5.
- ^ a b c Warren, Neville G. (2000). Excel Preliminary Physics. Pascal Press. tr. 47. ISBN 1-74020-085-3.
- ^ a b “Galvanic Cell”. The New International Encyclopaedia. Dodd, Mead and Company. 1903. tr. 80.
- ^ a b c Cotton 1999, tr. 626
- ^ Jasinski, Stephen M. “Mineral Commodity Summaries 2007: Zinc” (PDF). United States Geological Survey. Truy cập ngày 25 tháng 11 năm 2008.
- ^ Pearson, Madelene (12 tháng 12 năm 2006). “Zinifex, Umicore to Merge Smelters, Sell Shares (Update10)”. Bloomberg News. International Herald Tribune. Truy cập ngày 12 tháng 4 năm 2012. Đã bỏ qua tham số không rõ
|published=(trợ giúp); Đã bỏ qua tham số không rõ|coauthors=(gợi ý|author=) (trợ giúp) - ^ “Zinc Recycling”. International Zinc Association. Truy cập ngày 28 tháng 11 năm 2008.
- ^ “Special High Grade Zinc (SHG) 99.995%” (PDF). Nyrstar. 2008. Bản gốc (PDF) lưu trữ 27/5/2008. Truy cập ngày 1 tháng 12 năm 2008. Kiểm tra giá trị ngày tháng trong:
|archivedate=(trợ giúp) - ^ a b c d e Porter, Frank C. (1991). Zinc Handbook. CRC Press. ISBN 9780824783402.
- ^ a b c Rosenqvist, Terkel (1922). Principles of Extractive Metallurgy (ấn bản 2). Tapir Academic Press. tr. 7, 16, 186. ISBN 8251919223.
- ^ Borg, Gregor (2003). “Geology of the Skorpion Supergene Zinc Deposit, Southern Namibia”. Economic Geology. 98 (4): 749. doi:10.2113/98.4.749. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp) - ^ Bodsworth, Colin (1994). The Extraction and Refining of Metals. CRC Press. tr. 148. ISBN 0849344336.
- ^ Gupta, C. K. (1990). Hydrometallurgy in Extraction Processes. CRC Press. tr. 62. ISBN 0849368049. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ a b Kucha, H. (1996). “Primary minerals of Zn-Pb mining and metallurgical dumps and their environmental behavior at Plombières, Belgium”. Environmental Geology. 27 (1): 1. Bibcode:1996EnGeo..27....1K. doi:10.1007/BF00770598. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ a b c d e f Broadley, M. R. (2007). “Zinc in plants”. New Phytologist. 173 (4): 677. doi:10.1111/j.1469-8137.2007.01996.x. PMID 17286818. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ a b c d Emsley 2001, tr. 504
- ^ Heath, Alan G. (1995). Water pollution and fish physiology. Boca Raton, Florida: CRC Press. tr. 57. ISBN 0873716329.
- ^ “Derwent Estuary – Water Quality Improvement Plan for Heavy Metals”. Derwent Estuary Program. tháng 6 năm 2007. Truy cập ngày 11 tháng 7 năm 2009.
- ^ “The Zinc Works”. TChange. Truy cập ngày 11 tháng 7 năm 2009.
- ^ Prasad A. S. (2008). “Zinc in Human Health: Effect of Zinc on Immune Cells”. Mol. Med. 14 (5–6): 353. doi:10.2119/2008-00033.Prasad. PMC 2277319. PMID 18385818. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp) - ^ Zinc's role in microorganisms is particularly reviewed in: Sugarman B (1983). “Zinc and infection”. Review of Infectious Diseases. 5 (1): 137. doi:10.1093/clinids/5.1.137. PMID 6338570. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp) - ^ a b NRC 2000, tr. 443
- ^ Cotton 1999, tr. 625–629
- ^ a b Brandt, Erik G.; và đồng nghiệp (2009). “Molecular dynamics study of zinc binding to cysteines in a peptide mimic of the alcohol dehydrogenase structural zinc site”. Phys. Chem. Chem. Phys. 11 (6): 975–83. Bibcode:2009PCCP...11..975B. doi:10.1039/b815482a. PMID 19177216. “Và đồng nghiệp” được ghi trong:
|author=(trợ giúp) - ^ a b c Rink, L. (2000). “Zinc and the immune system”. Proc Nutr Soc. 59 (4): 541. doi:10.1017/S0029665100000781. PMID 11115789. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ Wapnir, Raul A. (1990). Protein Nutrition and Mineral Absorption. Boca Raton, Florida: CRC Press. ISBN 0849352274.
- ^ a b Berdanier, Carolyn D. (2007). Handbook of Nutrition and Food. Boca Raton, Florida: CRC Press. ISBN 0849392187. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ a b c Bitanihirwe BK, Cunningham MG (2009). “Zinc: The brain's dark horse”. Synapse. 63 (11): 1029. doi:10.1002/syn.20683. PMID 19623531. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp) - ^ Nakashima AS, Dyck RH (2009). “Zinc and cortical plasticity”. Brain Res Rev. 59 (2): 347. doi:10.1016/j.brainresrev.2008.10.003. PMID 19026685. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp) - ^ Stipanuk, Martha H. (2006). Biochemical, Physiological & Molecular Aspects of Human Nutrition. W. B. Saunders Company. tr. 1043–1067. ISBN 9780721644523.
- ^ a b Greenwood 1997, tr. 1224–1225
- ^ Kohen, Amnon (2006). Isotope Effects in Chemistry and Biology. Boca Raton, Florida: CRC Press. tr. 850. ISBN 0824724496. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ a b Greenwood 1997, tr. 1225
- ^ Cotton 1999, tr. 627
- ^ Gadallah, M. A. A. (2000). “Effects of indole-3-acetic acid and zinc on the growth, osmotic potential and soluble carbon and nitrogen components of soybean plants growing under water deficit”. Journal of Arid Environments. 44 (4): 451. doi:10.1006/jare.1999.0610.
- ^ Cotton 1997, tr. 628
- ^ Whitney, Eleanor Noss (2005). Understanding Nutrition (ấn bản 10). Thomson Learning. tr. 447–450. ISBN 978-1-4288-1893-4. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp) - ^ a b NRC 2000, tr. 447
- ^ Hershfinkel, Michal (2007). “The Zinc Sensing Receptor, a Link Between Zinc and Cell Signaling”. Molecular Medicine. 13 (7–8): 331. doi:10.1007/s10653-009-9255-4. PMC 1952663. PMID 17728842. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ Cotton 1999, tr. 629
- ^ Blake, Steve (2007). Vitamins and Minerals Demystified. McGraw-Hill Professional. tr. 242. ISBN 0-07-148901-0.
- ^ a b c Fosmire, G. J. (1990). “Zinc toxicity”. American Journal of Clinical Nutrition. 51 (2): 225. PMID 2407097. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp) - ^ a b Connie W. Bales; Christine Seel Ritchie (21 tháng 5 năm 2009). Handbook of Clinical Nutrition and Aging. Springer. tr. 151–. ISBN 9781603273848. Truy cập ngày 23 tháng 6 năm 2011.
- ^ a b NRC 2000, tr. 442
- ^ “National Agricultural Library”. Nal.usda.gov. Truy cập ngày 13 tháng 11 năm 2011.
- ^ Ensminger, Audrey H. (1993). Foods & Nutrition Encyclopedia (ấn bản 2). Boca Raton, Florida: CRC Press. tr. 2368–2369. ISBN 0849389801. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ “Zinc content of selected foods per common measure” (PDF). USDA National Nutrient Database for Standard Reference, Release 20. United States Department of Agriculture. Truy cập ngày 6 tháng 12 năm 2007.
- ^ a b Allen, Lindsay H. (1998). “Zinc and micronutrient supplements for children” (PDF). American Journal of Clinical Nutrition. 68 (2 Suppl): 495S. PMID 9701167. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp) - ^ Maret, W. (2006). “Zinc requirements and the risks and benefits of zinc supplementation”. Journal of Trace Elements in Medicine and Biology. 20 (1): 3. doi:10.1016/j.jtemb.2006.01.006. PMID 16632171. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ “Zinc – Summary”. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc (2001). Institute of Medicine, Food and Nutrition Board. Truy cập ngày 30 tháng 3 năm 2010.
- ^ Ibs, K. H. (2003). “Zinc-altered immune function”. Journal of Nutrition. 133 (5 Suppl 1): 1452S. PMID 12730441. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp)Quản lý CS1: dấu chấm câu dư (liên kết) - ^ a b c “Position of the American Dietetic Association and Dietitians of Canada: Vegetarian diets”. Journal of the American Dietetic Association, 2003, 06. Retrieved 4 January 2007.
- ^ Freeland-Graves J. H., Bodzy P. W., Epright M. A.. "Zinc status of vegetarians". Journal of the American Dietetic Association 1980 (77): 655–661.
- ^ Hambidge, M. (2003). “Biomarkers of trace mineral intake and status”. Journal of Nutrition. 133. 3 (3): 948S. PMID 12612181. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp) - ^ a b WHO contributors (2007). “The impact of zinc supplementation on childhood mortality and severe morbidity”. Tổ chức Y tế Thế giới. Truy cập ngày 1 tháng 3 năm 2009.
- ^ Shrimpton, R. (2005). “Zinc deficiency: what are the most appropriate interventions?”. British Medical Journal. 330 (7487): 347. doi:10.1136/bmj.330.7487.347. PMC 548733. PMID 15705693. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ Eisler, Ronald (1993). “Zinc Hazard to Fish, Wildlife, and Invertebrates: A Synoptic Review” (PDF). Contaminant Hazard Reviews. Laurel, Maryland: U.S. Department of the Interior, Fish and Wildlife Service (10).
- ^ Muyssen, Brita, T. A. (2006). “Mechanisms of chronic waterborne Zn toxicity in Daphnia magna”. Aquatic Toxicology. 77 (4): 393. doi:10.1016/j.aquatox.2006.01.006. PMID 16472524. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ Bothwell, Dawn N. (2003). “Chronic Ingestion of a Zinc-Based Penny”. Pediatrics. 111 (3): 689. doi:10.1542/peds.111.3.689. PMID 12612262. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp); Đã định rõ hơn một tham số trong|pages=và|page=(trợ giúp) - ^ Johnson AR, Munoz A, Gottlieb JL, Jarrard DF (2007). “High dose zinc increases hospital admissions due to genitourinary complications”. J. Urol. 177 (2): 639. doi:10.1016/j.juro.2006.09.047. PMID 17222649. Đã định rõ hơn một tham số trong
|pages=và|page=(trợ giúp)Quản lý CS1: nhiều tên: danh sách tác giả (liên kết) - ^ Oxford, J. S.; Öberg, Bo (1985). Conquest of viral diseases: a topical review of drugs and vaccines. Elsevier. tr. 142. ISBN 0-444-80566-4.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ “FDA says Zicam nasal products harm sense of smell”. Los Angeles Times. 17 tháng 6 năm 2009.
- ^ Barceloux, Donald G. (1999). “Zinc”. Clinical Toxicology. 37 (2): 279. doi:10.1081/CLT-100102426. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Bennett, Daniel R. M.D. (1997). “Zinc Toxicity Following Massive Coin Ingestion”. American Journal of Forensic Medicine & Pathology. 18 (2): 148. doi:10.1097/00000433-199706000-00008. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Fernbach, S. K. (1986). “Coin ingestion: unusual appearance of the penny in a child”. Radiology (bằng tiếng Anh). 158 (2): 512. PMID 3941880. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Stowe, C. M. (1978). “Zinc phosphide poisoning in dogs”. Journal of the American Veterinary Medical Association. 173 (3): 270. PMID 689968. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp) - ^ Reece, R. L. (1986). “Zinc toxicity (new wire disease) in aviary birds”. Australian Veterinary Journal. 63 (6): 199. doi:10.1111/j.1751-0813.1986.tb02979.x. Đã bỏ qua tham số không rõ
|coauthor=(gợi ý|author=) (trợ giúp)
Tham chiếu
- Chambers, William and Robert (1901). Chambers's Encyclopaedia: A Dictionary of Universal Knowledge . London and Edinburgh: J. B. Lippincott Company.Quản lý CS1: ref trùng mặc định (liên kết)
- Cotton, F. Albert (1999). Advanced Inorganic Chemistry (ấn bản 6). New York: John Wiley & Sons, Inc. ISBN 04711999575 Kiểm tra giá trị
|isbn=: số con số (trợ giúp). Đã bỏ qua tham số không rõ|coauthors=(gợi ý|author=) (trợ giúp)Quản lý CS1: ref trùng mặc định (liên kết) - CRC contributors (2006). David R. Lide (biên tập). Handbook of Chemistry and Physics (ấn bản 87). Boca Raton, Florida: CRC Press, Taylor & Francis Group. ISBN 0-8493-0487-3.
- Emsley, John (2001). “Zinc”. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. tr. 499–505. ISBN 0-19-850340-7.Quản lý CS1: ref trùng mặc định (liên kết)
- Greenwood, N. N. (1997). Chemistry of the Elements (ấn bản 2). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4. Đã bỏ qua tham số không rõ
|coauthors=(gợi ý|author=) (trợ giúp)Quản lý CS1: ref trùng mặc định (liên kết) - Heiserman, David L. (1992). “Element 30: Zinc”. Exploring Chemical Elements and their Compounds. New York: TAB Books. ISBN 0-8306-3018-X.Quản lý CS1: ref trùng mặc định (liên kết)
- Lehto, R. S. (1968). “Zinc”. Trong Clifford A. Hampel (biên tập). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. tr. 822–830. ISBN 0442155980. LCCN 68-29938.Quản lý CS1: ref trùng mặc định (liên kết)
- United States National Research Council, Institute of Medicine. (2000). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. National Academies Press. tr. 442–455.
- Stwertka, Albert (1998). “Zinc”. Guide to the Elements . Oxford University Press. ISBN 0-19-508083-1.Quản lý CS1: ref trùng mặc định (liên kết)
- Weeks, Mary Elvira (1933). “III. Some Eighteenth-Century Metals”. The Discovery of the Elements. Easton, PA: Journal of Chemical Education. ISBN 0766138720.Quản lý CS1: ref trùng mặc định (liên kết)
Liên kết ngoài
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Kẽm. |
- WebElements.com – Zinc (tiếng Anh)
- Kẽm – History, sources, production, uses, health, and Zinc deficiency (tiếng Anh)
- EnvironmentalChemistry.com – Zinc (tiếng Anh)
- Discovering the 8th metal (tiếng Anh)
- Reuters Health - Zinc-fortified foods may help seventh graders perform better in school (tiếng Anh)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
Bản mẫu:Liên kết bài chất lượng tốt Bản mẫu:Liên kết bài chất lượng tốt



