Natri chlorat
| Natri chlorat | |||
|---|---|---|---|
| |||
 Bột natri chlorrat | |||
 | |||
| Tên khác | Natri chlorat(V) | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| KEGG | |||
| MeSH | |||
| ChEBI | |||
| Số RTECS | FO0525000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| ChemSpider | |||
| UNII | |||
| Thuộc tính | |||
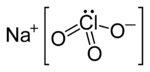
| Công thức phân tử | NaClO3 | ||
| Khối lượng mol | 106,4399 g/mol | ||
| Bề ngoài | dạng rắn màu trắng | ||
| Mùi | không mùi | ||
| Khối lượng riêng | 2,5 g/cm³ | ||
| Điểm nóng chảy | 248 °C (521 K; 478 °F) | ||
| Điểm sôi | ≈ 300 °C (573 K; 572 °F) (phân hủy) | ||
| Độ hòa tan trong nước | 101 g/100 mL (20 ℃), xem thêm bảng độ tan | ||
| Chiết suất (nD) | 1,572 | ||
| Cấu trúc | |||
| Các nguy hiểm | |||
| Phân loại của EU | Chất oxy hóa (O) Chất có hại (Xn) Nguy hiểm cho môi trường (N) | ||
| Chỉ mục EU | 017-005-00-9 | ||
| NFPA 704 |
| ||
| Chỉ dẫn R | R9, R22, R51/53 (xem Danh sách nhóm từ R) | ||
| Chỉ dẫn S | S2, S13, S17, S46, S61 (xem Danh sách nhóm từ S) | ||
| Điểm bắt lửa | không | ||
| Các hợp chất liên quan | |||
| Anion khác | Natri chloride Natri hypochlorrit Natri chlorrit Natri perchlorat Natri bromat Natri iođat | ||
| Cation khác | Amoni chlorrat Kali chlorrat Bari chlorrat | ||
| Hợp chất liên quan | Acid chlorric | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Natri chlorat là một hợp chất vô cơ có công thức hóa học NaClO3. Khi ở dạng nguyên chất, nó là tinh thể màu trắng dạng bột dễ dàng hoà tan vào nước. Nó là chất hút ẩm. Hợp chất này phân hủy ở nhiệt độ trên 300 ℃ để giải phóng khí oxi và còn lại natri chloride.
Tổng hợp[sửa | sửa mã nguồn]
Trong công nghiệp, natri chlorat được tổng hợp từ việc điện phân dung dịch muối ăn đun nóng trong bình điện phân:
- NaCl + 3H2O → NaClO3 + 3H2↑
Nó còn được tổng hợp bằng cách dẫn khí chlor qua dung dịch NaOH đun nóng, rồi được tinh chế bằng việc kết tinh natri chlorat.
Sử dụng[sửa | sửa mã nguồn]
Ứng dụng thương mại chính của natri chlorat là để điều chế chlor dioxide, ClO2. Ứng dụng nhiều nhất chiếm 95% lượng chlorat là làm chất tẩy trắng giấy trong đó ClO2 là chất tẩy trắng nổi bật nhất.
Chất diệt cỏ[sửa | sửa mã nguồn]
Natri chlorat được dùng như là một thuốc diệt cỏ không chọn lọc. Nó được xem là chất độc cho mọi loại cây xanh. Nó còn có thể giết chết cả phần rễ cây.
Natri chlorat có thể dùng để kiểm soát:
- bìm bìm hoa tía (morning glory),
- kế Canada (Canada thistle),
- cỏ cao (johnson grass),
- tre,
- cỏ lưỡi chó (ragwort) và
- cỏ St John's.
Thuốc diệt cỏ này được dùng chủ yếu trên đất phi nông nghiệp cho việc xử lý mặt bằng và kiểm soát cây cối trên lề đường, bờ rào, mương rãnh...
Natri chlorat còn là chất làm khô và chất làm rụng lá cho:
- cây bông,
- cây rum (saffluorwer),
- ngô,
- lanh,
- ớt,
- đậu nành,
- lúa miến,
- đậu Hà Lan,
- hạt khô,
- lúa và
- hoa hướng dương.
Nếu trộn với atrazine, tính hiệu quả sẽ kéo dài hơn. Nếu trộn với 2,4-D, nó sẽ cải thiện được chất lượng sản phẩm. Hỗn hợp với các chất diệt cỏ khác trong dung dịch có nước có phạm vi chứng nào nó không dễ bị oxi hoá.
Tạo khí oxi[sửa | sửa mã nguồn]
Chất tạo khí oxi, ví dụ, trong ngành hàng không dân dụng cung cấp oxi cấp cứu cho hành khách để bảo vệ họ khỏi bị tụt áp suất bằng cách phân hủy natri chlorat có xúc tác. Chất xúc tác thường là bột sắt. Bari peroxide (BaO2) dùng để hấp thụ khí chlor là phụ phẩm của quá trình phân hủy.[1]
Natri chlorat được dùng trong một vài máy bay như là nguồn oxi bổ sung. Bột sắt được trộn vào natri chlorat và được kích thích bằng sự phóng điện mà được làm cho hoạt động khi kéo mặt nạ cấp cứu. Phản ứng tạo nhiều oxi hơn yêu cầu cho việc cháy.
Tính độc đối với người[sửa | sửa mã nguồn]
Do tính oxi hoá tự nhiên, natri chlorat rất độc nếu ăn phải. Tác động oxi hoá lên hemoglobin dẫn đến việc tạo thành methaemoglobin, được tạo thành bởi sự biến chất của globin và một sự liên kết chéo của màng protein hồng cầu với sự phá hủy lên enzim màng. Điều này lại dẫn đến việc gia tăng tính thấm của màng và xuất huyết dữ dội. Sự biến chất của hemoglobin vượt quá khả năng trao đổi của G6PD. Thêm vào đó, enzim này bị làm biến chất trực tiếp bởi vì chlorat làm giảm hoạt động của nó.
Liệu pháp điều trị với acid ascorbic và xanh mêtylen được dùng để điều trị chứng dư methaemoglobin. Tuy nhiên, do xanh mêtylen cần sự có mặt của NADPH mà lại cần G6PD hoạt động bình thường nên ít hiệu quả hơn ở môi trường tiêu biểu của sự oxi hoá hemoglobin.
Việc xuất huyết dữ dội cấp tính dẫn đến DIC và suy thận. Thêm vào đó, độc tính ảnh hưởng trực tiếp vào ống thận.[2]. Sự điều trị sẽ bao gồm truyền máu, thẩm tách màng bụng hay máu.[3]
Các dạng[sửa | sửa mã nguồn]
Natri chlorat gồm dạng bột, bụi nước và dạng hạt. Có rủi ro về hoả hoạn và cháy nổ khi ở dạng hỗn hợp khô với các chất khác, đặc biệt là các vật liệu hữu cơ như các thuốc diệt cỏ khác, lưu huỳnh, phosphor, kim loại dạng bột, acid mạnh. Đặc biệt khi trộn với đường nó có đặc tính gây nổ. Nếu có trộn với các chất trên không nên lưu trữ trong nhà hay trong gara.[4]
Dạng bán ngoài thị trường có chứa chất chống cháy, nhưng vẫn có ảnh hưởng nhỏ nếu cố ý đốt. Chất diệt cỏ thương mại thông dụng chứa xấp xỉ 53% natri chlorat với chất chống cháy như natri metaborat hay amoni phosphat.
Tên thương mại[sửa | sửa mã nguồn]
Thành phần natri chlorat công hiệu được tìm thấy trong nhiều loại thuốc diệt cỏ thương mại. Một vài tên thương mại của các sản phẩm chứa natri chlorat như Atlacide, Defol, De-Fol-Ate, Drop-Leaf, Fall, Harvest-Aid, Kusatol, Leafex, và Tumbleaf. Hợp chất này có thể được dùng kết hợp với các chất diệt cỏ khác như atrazine, 2,4-D, bromacil, diuron, và natri metaborat. Ở Anh có nhiều loại thuốc diệt cỏ chứa natri chlorat, trong đó được biết nhiều nhất là Doff và Wilkinsons. Ở Ý được bán dưới tên Zapi.
Thu hồi khỏi thị trường[sửa | sửa mã nguồn]
Các sản phẩm natri chlorat bị thu hồi khỏi thị trường vì một quyết định của EC về hoá chất và mối nguy hiểm của nó. Các sản phẩm này không được mua bán sau ngày 30 tháng 9 năm 2009 và không cho phép bất cứ ai sử dụng sau ngày 10 tháng 5 năm 2010.
Tham khảo[sửa | sửa mã nguồn]
- Vào tháng 5 năm 2006, phần Chiếc quần nổ tung (Exploding Pants) của chương trình MythBusters, natri chlorrat được dùng như "nguyên liệu đặc biệt" để khám phá câu chuyện một nông dân New Zealand mà chiếc quần của anh ta bị nổ tung hoặc bị bắt lửa vào năm 1931 dẫn đến cái chết.
- James Watson của trường Đại học Massey ở New Zealand đã đoạt giải Ig Nobel Prize về lịch sử nông nghiệp vào tháng 10 năm 2005 vì khám phá của ông về chiếc quần nổ tung đầu thập niên 1930 ở New Zealand.
Tham khảo[sửa | sửa mã nguồn]
- ^ Yunchang Zhang, Girish Kshirsagar, và James C. Cannon (1993). “Chức năng của Bari peroxide trong việc tạo khí oxi của natri chlorrat”. Ind. Eng. Chem. Res. 32 (5): 966–969. doi:10.1021/ie00017a028.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Nguyên nhân bệnh suy thận cấp tính kết hợp với tổn thương do độc và do chấn thương; phần chứng thiếu máu cục bộ ở thận, tổn thương thận do độc và thiếu máu cục bộ. OLIVER J, MacDOWELL M, TRACY A. J Clin Invest. 1951 Dec;30(12:1):1307-439. pmid:14897900
- ^ Goldfrank's Toxicologic Emergencies, McGraw-Hill Professional; 8th edition (ngày 28 tháng 3 năm 2006), ISBN 978-0071437639
- ^ Beveridge, Alexander (1998). Forensic Investigation of Explosions. Taylor & Francis Ltd. ISBN 0-7484-0565-8.
- "Chlorate de potassium. Chlorate de sodium", Fiche toxicol. n° 217, Paris:Institut national de recherche et de sécurité, 2000. 4pp.
Liên kết ngoài[sửa | sửa mã nguồn]
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Natri chlorat. |



